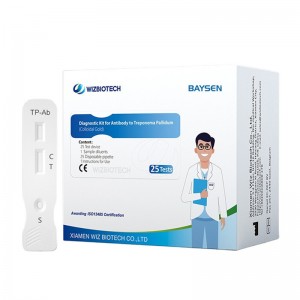
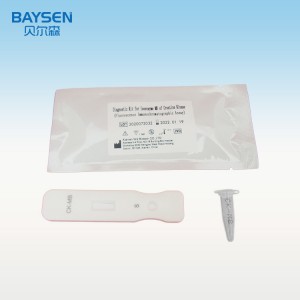
Strisce/cassette per test rapidi HCV di buona qualità in Cina, standard aziendale
Grazie alla nostra tecnologia all'avanguardia e al nostro spirito di innovazione, cooperazione reciproca, vantaggi e sviluppo, costruiremo un futuro prospero insieme alla vostra stimata azienda per Good Quality China HCV Rapid Test Strip/Cassette Enterprise Standard. Essendo un'organizzazione giovane e in crescita, potremmo non essere i migliori, ma abbiamo fatto del nostro meglio per essere il vostro ottimo partner.
Con la nostra tecnologia all'avanguardia e contemporaneamente il nostro spirito di innovazione, cooperazione reciproca, benefici e sviluppo, costruiremo un futuro prospero insieme alla vostra stimata impresa perAnti-HCV-Ns, virus dell'epatite C cineseInsistiamo sempre sul principio di gestione "La qualità è al primo posto, la tecnologia è la base, l'onestà e l'innovazione". Siamo stati in grado di sviluppare continuamente nuovi prodotti e soluzioni a un livello superiore per soddisfare le diverse esigenze dei clienti.
Solo per uso diagnostico in vitro
Si prega di leggere attentamente il foglietto illustrativo prima dell'uso e di seguirne scrupolosamente le istruzioni. L'affidabilità dei risultati del test non può essere garantita in caso di divergenze dalle istruzioni contenute nel foglietto illustrativo.
USO PREVISTO
Il kit diagnostico per gli anticorpi del virus dell'epatite C (test immunocromatografico a fluorescenza) è un test immunocromatografico a fluorescenza per la rilevazione quantitativa degli anticorpi anti-HCV nel siero o plasma umano, importante strumento diagnostico ausiliario per l'infezione da epatite C. Tutti i campioni positivi devono essere confermati con altre metodologie. Questo test è destinato esclusivamente all'uso professionale sanitario.
1. Lasciare da parte tutti i reagenti e i campioni a temperatura ambiente.
2. Aprire l'analizzatore immunitario portatile (WIZ-A101), immettere la password di accesso dell'account in base al metodo di funzionamento dello strumento e accedere all'interfaccia di rilevamento.
3. Scansiona il codice di identificazione per confermare l'articolo in prova.
4. Estrarre la scheda di prova dal sacchetto di alluminio.
5. Inserire la scheda di prova nell'apposito slot, scansionare il codice QR e determinare l'elemento da testare.
6. Aggiungere 20 μL di campione di siero o plasma al diluente del campione e mescolare bene.
7. Aggiungere 80 μL di soluzione campione nel pozzetto del cartoncino.
8. Fare clic sul pulsante "test standard", dopo 15 minuti lo strumento rileverà automaticamente la scheda di prova, potrà leggere i risultati dallo schermo di visualizzazione dello strumento e registrare/stampare i risultati del test.
9. Fare riferimento alle istruzioni dell'analizzatore immunitario portatile (WIZ-A101).
RIEPILOGO
Il virus dell'epatite C (HCV) è un virus a RNA a singolo filamento (9,5 kb) con envelope, a senso positivo, appartenente alla famiglia dei Flaviviridae. Sono stati identificati sei genotipi principali e una serie di sottotipi di HCV. Isolato nel 1989, l'HCV è ora riconosciuto come la principale causa di epatite non-A e non-B associata a trasfusione. La malattia è caratterizzata da una forma acuta e cronica. Oltre il 50% degli individui infetti sviluppa un'epatite cronica grave e potenzialmente letale, con cirrosi epatica e carcinomi epatocellulari. Dall'introduzione, nel 1990, dello screening anti-HCV per le donazioni di sangue, l'incidenza di questa infezione nei riceventi trasfusioni è stata significativamente ridotta. Studi clinici dimostrano che un numero significativo di individui infetti da HCV sviluppa anticorpi contro la proteina non strutturale NS5 del virus. Per questo motivo, i test includono antigeni della regione NS5 del genoma virale, oltre a NS3 (c200), NS4 (c200) e Core (c22).
PRINCIPIO DELLA PROCEDURA
La membrana del dispositivo di test è rivestita con l'antigene HCV nella zona di test e con l'anticorpo di capra anti-IgG di coniglio nella zona di controllo. Il tampone di etichettatura è preventivamente rivestito con l'antigene HCV marcato con fluorescenza e con IgG di coniglio. Quando si testa un campione positivo, l'anticorpo HCV nel campione si combina con l'antigene HCV marcato con fluorescenza, formando una miscela immunitaria. Sotto l'azione dell'immunocromatografia, il complesso fluisce nella direzione della carta assorbente; quando il complesso attraversa la zona di test, si combina con l'antigene HCV che riveste l'antigene, formando un nuovo complesso. Il livello di anticorpi HCV è positivamente correlato al segnale di fluorescenza e la concentrazione di anticorpi HCV nel campione può essere rilevata mediante un test immunoenzimatico a fluorescenza.
REAGENTI E MATERIALI FORNITI
Componenti del pacchetto 25T:
.Test card confezionata singolarmente in una busta di alluminio con un essiccante
Diluenti per campioni
.Foglio illustrativo
MATERIALI RICHIESTI MA NON FORNITI
Contenitore per la raccolta dei campioni, timer
RACCOLTA E CONSERVAZIONE DEI CAMPIONI
1. I campioni analizzati possono essere siero, plasma anticoagulante con eparina o plasma anticoagulante con EDTA.
2. Raccogliere il campione secondo le tecniche standard. Il campione di siero o plasma può essere conservato in frigorifero a 2-8 °C per 7 giorni e crioconservato a temperature inferiori a -15 °C per 6 mesi.
3. Tutti i campioni evitano cicli di congelamento-scongelamento.
PROCEDURA DI ANALISI
Prima di effettuare il test, leggere attentamente il manuale d'uso dello strumento e il foglietto illustrativo.
Il risultato di questo test è solo per riferimento clinico e non deve essere l'unica base per la diagnosi clinica e il trattamento; la gestione clinica del paziente deve essere valutata in modo completo, tenendo conto dei sintomi, dell'anamnesi, di altri esami di laboratorio, della risposta al trattamento, dell'epidemiologia e di altre informazioni.
Questo reagente è utilizzato solo per test su siero e plasma. Potrebbe non fornire risultati accurati se utilizzato su altri campioni come saliva, urina, ecc.
CARATTERISTICHE DELLE PRESTAZIONI
| Linearità | 0,005-5 | deviazione relativa: da -15% a +15%. |
| Coefficiente di correlazione lineare: (r) ≥ 0,9900 | ||
| Precisione | Il tasso di recupero dovrà essere compreso tra l'85% e il 115%. | |
| Ripetibilità | CV≤15% | |
RIFERIMENTI
1. Epatite post-trasfusionale. In: Moore SB, a cura di. Malattie virali trasmesse tramite trasfusione. Alington, VA. Am. Assoc. Blood Banks, pp. 53-38.
2.Hansen JH,et al.Interferenza HAMA con immunoassay basati su anticorpi monoclonali murini[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS. La natura degli anticorpi eterofili e il ruolo nell'interferenza dei test immunoenzimatici[J].J of Clin Immunoassay,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, et al. (1978) Agente trasmissibile nell'epatite non-A, non-B. Lancet I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus dell'epatite C: il principale agente causale dell'epatite virale non-A, non-B. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Saggio immunoenzimatico (ELISA): dosaggio qualitativo delle IgG. Immunochimica 8:871-874.
VALORI ATTESI
Anticorpi HCV <0,02
Si raccomanda che ogni laboratorio stabilisca il proprio intervallo di normalità rappresentativo della propria popolazione di pazienti.
RISULTATI DEI TEST E INTERPRETAZIONE
- I dati sopra riportati sono il risultato del test del reagente HCV-Ab e si suggerisce che ogni laboratorio stabilisca un intervallo di valori di rilevamento HCV-Ab adatto alla popolazione di questa regione. I risultati sopra riportati sono solo a scopo di riferimento.
- I risultati di questo metodo sono applicabili solo agli intervalli di riferimento stabiliti in questo metodo e non vi è alcuna comparabilità diretta con altri metodi.
- Anche altri fattori possono causare errori nei risultati del rilevamento, tra cui motivi tecnici, errori operativi e altri fattori legati al campione.
CONSERVAZIONE E STABILITÀ
- Il kit ha una validità di 18 mesi dalla data di produzione. Conservare i kit non utilizzati a 2-30 °C. NON CONGELARE. Non utilizzare oltre la data di scadenza.
- Non aprire la busta sigillata finché non si è pronti a eseguire il test; si consiglia di utilizzare il test monouso nell'ambiente richiesto (temperatura 2-35°C, umidità 40-90%) entro 60 minuti il più rapidamente possibile.
- Il diluente del campione viene utilizzato immediatamente dopo l'apertura.
AVVERTENZE E PRECAUZIONI
Il kit deve essere sigillato e protetto dall'umidità.
Tutti i campioni positivi dovranno essere convalidati con altre metodologie.
.Tutti i campioni devono essere trattati come potenziali inquinanti.
.NON utilizzare reagenti scaduti.
.NON scambiare i reagenti tra kit con lotti diversi.
.NON riutilizzare le schede di test e gli accessori monouso.
.Un funzionamento errato, un campione eccessivo o insufficiente possono causare deviazioni nei risultati.
LIMITAZIONE
.Come per qualsiasi test che utilizzi anticorpi murini, esiste la possibilità di interferenza da parte di anticorpi umani anti-topo (HAMA) presenti nel campione. I campioni di pazienti che hanno ricevuto preparazioni di anticorpi monoclonali a scopo diagnostico o terapeutico possono contenere HAMA. Tali campioni possono causare risultati falsi positivi o falsi negativi.
Legenda dei simboli utilizzati:
 | Dispositivo medico diagnostico in vitro |
 | Produttore |
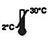 | Conservare a 2-30℃ |
 | Data di scadenza |
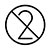 | Non riutilizzare |
 | ATTENZIONE |
 | Consultare le istruzioni per l'uso |