Bra kvalitet Kina HCV snabbtestremsa/kassett Enterprise Standard
Med vår ledande teknik samtidigt som vår innovationsanda, ömsesidiga samarbete, fördelar och utveckling, kommer vi att bygga en framgångsrik framtid tillsammans med ert uppskattade företag för Good Quality China HCV Rapid Test Strip/Cassette Enterprise Standard. Som en ung, växande organisation kanske vi inte är de bästa, men vi har gjort vårt bästa för att vara er mycket bra partner.
Med vår ledande teknik samtidigt som vår innovationsanda, ömsesidiga samarbete, fördelar och utveckling, kommer vi att bygga en blomstrande framtid tillsammans med ert uppskattade företag.Anti-HCV-Ns, Kinas hepatit C-virusVi insisterar alltid på ledningsprincipen "Kvalitet är först, teknik är grunden, ärlighet och innovation". Vi har kunnat utveckla nya produkter och lösningar kontinuerligt till en högre nivå för att tillgodose kundernas olika behov.
Endast för in vitro-diagnostiskt bruk
Läs noggrant igenom denna bipacksedel före användning och följ instruktionerna noggrant. Tillförlitligheten hos analysresultaten kan inte garanteras om det finns några avvikelser från instruktionerna i denna bipacksedel.
AVSEDD ANVÄNDNING
Diagnostiskt kit för hepatit C-virusantikroppar (fluorescensimmunokromatografisk analys) är en fluorescensimmunokromatografisk analys för kvantitativ detektion av HCV-antikroppar i humant serum eller plasma, vilket är ett viktigt hjälpdiagnostiskt värde för infektion med hepatit C. Alla positiva prover måste bekräftas med andra metoder. Detta test är endast avsett för användning av sjukvårdspersonal.
1. Ställ alla reagenser och prover åt sidan och låt dem svalna i rumstemperatur.
2. Öppna den bärbara immunanalysatorn (WIZ-A101), ange lösenordet för kontot/inloggningen enligt instrumentets driftsätt och gå sedan in i detekteringsgränssnittet.
3. Skanna identifieringskoden för att bekräfta testobjektet.
4. Ta ut testkortet ur foliepåsen.
5. Sätt i testkortet i kortplatsen, skanna QR-koden och identifiera testobjektet.
6. Tillsätt 20 μL serum- eller plasmaprov till provutspädningsvätskan och blanda väl.
7. Tillsätt 80 μL provlösning till kortets provbrunn.
8. Klicka på knappen ”standardtest”. Efter 15 minuter kommer instrumentet automatiskt att upptäcka testkortet, läsa resultaten från instrumentets skärm och registrera/skriva ut testresultaten.
9. Se instruktionerna för den bärbara immunanalysatorn (WIZ-A101).
SAMMANFATTNING
Hepatit C-virus (HCV) är ett höljevirus med enkelsträngat positivt sense-RNA (9,5 kb) som tillhör familjen Flaviviridae. Sex huvudsakliga genotyper och subtyper av HCV har identifierats. HCV isolerades 1989 och är nu erkänt som den främsta orsaken till transfusionsassocierad icke-A- och icke-B-hepatit. Sjukdomen kännetecknas av akut och kronisk form. Mer än 50 % av de infekterade individerna utvecklar allvarlig, livshotande kronisk hepatit med levercirros och hepatocellulära karcinom. Sedan anti-HCV-screening av bloddonationer infördes 1990 har incidensen av denna infektion hos transfusionsmottagare minskat avsevärt. Kliniska studier visar att en betydande mängd HCV-infekterade individer utvecklar antikroppar mot virusets icke-strukturella protein NS5. För detta inkluderar testerna antigener från NS5-regionen i virusgenomet utöver NS3 (c200), NS4 (c200) och Core (c22).
PRINCIP FÖR FÖRFARANDET
Testanordningens membran är belagt med HCV-antigen på testområdet och get-anti-kanin-IgG-antikropp på kontrollområdet. Märkningsplattorna är i förväg belagda med fluorescensmärkt HCV-antigen och kanin-IgG. Vid positivt test kombineras HCV-antikroppen i provet med fluorescensmärkt HCV-antigen och bildar en immunblandning. Under immunokromatografins inverkan flyter komplexet i riktning mot absorberande papper. När komplexet passerar testområdet kombineras det med HCV-antigenbeläggningsantigenet och bildar ett nytt komplex. HCV-antikroppsnivån korrelerar positivt med fluorescenssignalen, och koncentrationen av HCV-antikroppar i provet kan detekteras med fluorescensimmunanalys.
LEVERERADE REAGENSER OCH MATERIAL
25T-paketkomponenter:
Testkort individuellt förpackade i foliepåse med torkmedel
Provutspädningsmedel
Bipacksedel
NÖDVÄNDIG MATERIAL MEN EJ TILLHANDAHÅLLNA
Provtagningsbehållare, timer
PROVINSAMLING OCH FÖRVARING
1. De testade proverna kan vara serum, heparin-antikoagulantplasma eller EDTA-antikoagulantplasma.
2. Samla prov enligt standardtekniker. Serum- eller plasmaprovet kan förvaras kylt vid 2–8 ℃ i 7 dagar och kryokonservering vid högst -15 °C i 6 månader.
3. Alla prover undviker frys-tiningcykler.
ANALYSPROCEDUR
Läs instrumentets bruksanvisning och bipacksedel före testning.
Detta testresultat är endast för klinisk referens och bör inte fungera som enda grund för klinisk diagnos och behandling. Patientens kliniska behandling bör beaktas på ett omfattande sätt, inklusive symtom, sjukdomshistoria, andra laboratorieundersökningar, behandlingsrespons, epidemiologi och annan information.
Detta reagens används endast för serum- och plasmatester. Det kan vara svårt att få exakta resultat när det används för andra prover, såsom saliv och urin etc.
PRESTANDAEGENSKAPER
| Linjäritet | 0,005-5 | relativ avvikelse: -15 % till +15 %. |
| Linjär korrelationskoefficient: (r) ≥ 0,9900 | ||
| Noggrannhet | Återvinningsgraden ska ligga inom 85 % – 115 %. | |
| Repeterbarhet | CV≤15% | |
REFERENSER
1. Hepatit efter transfusion. I: Moore SB, red. Transfusionsöverförda virussjukdomar. Alington, VA. Am. Assoc. Blood Banks, s. 53-38.
2. Hansen JH, et al. HAMA-interferens med immunoanalyser baserade på murina monoklonala antikroppar [J]. J of Clin Immunoassay, 1993, 16: 294-299.
3. Levinson SS. Heterofila antikroppars natur och deras roll i immunanalysinterferens [J]. J of Clin Immunoassay, 1992, 15: 108-114.
4. Alter HJ., Purcell RH, Holland PV, et al. (1978) Överförbart agens vid hepatit av typen icke-A och icke-B. Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Hepatit C-virus: den främsta orsaken till viral icke-A-, icke-B-hepatit. Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Enzymlänkad immunosorbentanalys (ELISA): kvalitativ analys av IgG. Immunochemistry 8:871-874.
FÖRVÄNTAD VÄRDEN
HCV-Ab<0,02
Det rekommenderas att varje laboratorium fastställer sitt eget normalintervall som representerar dess patientpopulation.
TESTRESULTAT OCH TOLKNING
- Ovanstående data är resultatet av HCV-Ab-reagenstest, och det föreslås att varje laboratorium fastställer ett intervall av HCV-Ab-detektionsvärden som är lämpliga för befolkningen i denna region. Ovanstående resultat är endast för referens.
- Resultaten från denna metod är endast tillämpliga på de referensintervall som fastställts i denna metod, och det finns ingen direkt jämförbarhet med andra metoder.
- Andra faktorer kan också orsaka fel i detektionsresultaten, inklusive tekniska orsaker, driftsfel och andra urvalsfaktorer.
FÖRVARING OCH STABILITET
- Kitet har en hållbarhet på 18 månader från tillverkningsdatum. Förvara oanvända kit vid 2–30 °C. FÅR EJ FRYSAS. Använd inte efter utgångsdatumet.
- Öppna inte den förseglade påsen förrän du är redo att utföra ett test, och engångstestet rekommenderas att användas i den erforderliga miljön (temperatur 2–35 ℃, luftfuktighet 40–90 %) inom 60 minuter så snart som möjligt.
- Provutspädningsvätskan används omedelbart efter öppning.
VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER
Satsen ska vara förseglad och skyddad mot fukt.
Alla positiva prover ska valideras med andra metoder.
.Alla prover ska behandlas som potentiella förorenande ämnen.
.ANVÄND INTE utgånget reagens.
.Byt INTE reagenser mellan kit med olika lotnummer.
.Återanvänd INTE testkort och andra engångstillbehör.
.Felaktig användning, för stort eller litet prov kan leda till avvikelser i resultatet.
LIMITATION
.Som med alla analyser som använder musantikroppar finns det en risk för interferens från humana anti-musantikroppar (HAMA) i provet. Prover från patienter som har fått preparat av monoklonala antikroppar för diagnos eller behandling kan innehålla HAMA. Sådana prover kan orsaka falskt positiva eller falskt negativa resultat.
Förklaring till använda symboler:
 | Medicinteknisk produkt för in vitro-diagnostik |
 | Tillverkare |
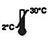 | Förvaras vid 2–30 ℃ |
 | Utgångsdatum |
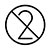 | Återanvänd inte |
 | FÖRSIKTIGHET |
 | Se bruksanvisningen |