Kit de diagnóstico para anticorpo do vírus da hepatite C (ensaio imunocromatográfico de fluorescência)
Somente para uso diagnóstico in vitro
Leia atentamente esta bula antes de usar e siga rigorosamente as instruções. A confiabilidade dos resultados do ensaio não pode ser garantida em caso de divergências em relação às instruções contidas nesta bula.
USO PRETENDIDO
O Kit Diagnóstico para Anticorpos do Vírus da Hepatite C (Ensaio Imunocromatográfico de Fluorescência) é um ensaio imunocromatográfico de fluorescência para a detecção quantitativa de anticorpos do VHC em soro ou plasma humano, o que representa um importante valor auxiliar no diagnóstico da infecção por hepatite C. Todas as amostras positivas devem ser confirmadas por outras metodologias. Este teste destina-se apenas ao uso por profissionais de saúde.
1. Deixe todos os reagentes e amostras em temperatura ambiente.
2. Abra o Analisador Imunológico Portátil (WIZ-A101), insira a senha de login da conta de acordo com o método de operação do instrumento e entre na interface de detecção.
3. Leia o código de identificação para confirmar o item de teste.
4. Retire o cartão de teste do saco de alumínio.
5. Insira o cartão de teste no slot para cartão, escaneie o código QR e determine o item de teste.
6. Adicione 20 μL de amostra de soro ou plasma ao diluente de amostra e misture bem.
7. Adicione 80 μL de solução de amostra ao poço de amostra do cartão.
8. Clique no botão “teste padrão”. Após 15 minutos, o instrumento detectará automaticamente o cartão de teste, poderá ler os resultados na tela do instrumento e registrar/imprimir os resultados do teste.
9. Consulte as instruções do Analisador Imunológico Portátil (WIZ-A101).
RESUMO
O vírus da hepatite C (VHC) é um vírus de RNA de fita simples, com envelope e sentido positivo (9,5 kb), pertencente à família Flaviviridae. Seis genótipos principais e séries de subtipos de VHC foram identificados. Isolado em 1989, o VHC é agora reconhecido como a principal causa de hepatite não A e não B associada a transfusões. A doença é caracterizada por formas aguda e crônica. Mais de 50% dos indivíduos infectados desenvolvem hepatite crônica grave e com risco de vida, com cirrose hepática e carcinomas hepatocelulares. Desde a introdução, em 1990, da triagem anti-VHC em doações de sangue, a incidência dessa infecção em receptores de transfusão foi significativamente reduzida. Estudos clínicos mostram que uma quantidade significativa de indivíduos infectados pelo VHC desenvolve anticorpos contra a proteína não estrutural NS5 do vírus. Para isso, os testes incluem antígenos da região NS5 do genoma viral, além de NS3 (c200), NS4 (c200) e Core (c22).
PRINCÍPIO DO PROCEDIMENTO
A membrana do dispositivo de teste é revestida com antígeno do HCV na região de teste e anticorpo IgG de cabra anti-coelho na região de controle. A almofada de marcação é previamente revestida com antígeno do HCV marcado por fluorescência e IgG de coelho. Ao testar uma amostra positiva, o anticorpo do HCV na amostra combina-se com o antígeno do HCV marcado por fluorescência, formando uma mistura imune. Sob a ação da imunocromatografia, o complexo flui na direção do papel absorvente e, ao passar pela região de teste, combina-se com o antígeno do revestimento do antígeno do HCV, formando um novo complexo. O nível de anticorpos do HCV está positivamente correlacionado com o sinal de fluorescência, e a concentração de anticorpos do HCV na amostra pode ser detectada por imunoensaio de fluorescência.
REAGENTES E MATERIAIS FORNECIDOS
Componentes do pacote 25T:
.Cartão de teste embalado individualmente em folha de alumínio com um dessecante
.Diluentes de amostra
.Instrução da embalagem
MATERIAIS NECESSÁRIOS MAS NÃO FORNECIDOS
Recipiente de coleta de amostra, temporizador
COLETA E ARMAZENAMENTO DE AMOSTRAS
1. As amostras testadas podem ser soro, plasma anticoagulante com heparina ou plasma anticoagulante com EDTA.
2. Coletar a amostra de acordo com as técnicas padrão. A amostra de soro ou plasma pode ser mantida refrigerada de 2 a 8°C por 7 dias e criopreservada abaixo de -15°C por 6 meses.
3.Todas as amostras evitam ciclos de congelamento e descongelamento.
PROCEDIMENTO DE ENSAIO
Leia o manual de operação do instrumento e a bula antes de testar.
Este resultado do teste é apenas para referência clínica e não deve servir como única base para diagnóstico e tratamento clínico. O manejo clínico do paciente deve ser uma consideração abrangente combinada com seus sintomas, histórico médico, outros exames laboratoriais, resposta ao tratamento, epidemiologia e outras informações.
Este reagente é usado apenas para testes de soro e plasma. Pode não obter resultados precisos quando usado para outras amostras, como saliva, urina, etc.
CARACTERÍSTICAS DE DESEMPENHO
| Linearidade | 0,005-5 | desvio relativo: -15% a +15%. |
| Coeficiente de correlação linear: (r) ≥ 0,9900 | ||
| Precisão | A taxa de recuperação deve estar entre 85% e 115%. | |
| Repetibilidade | CV≤15% | |
REFERÊNCIAS
1. Hepatite pós-transfusional. Em: Moore SB, ed. Doenças Virais Transmitidas por Transfusão. Alington, VA. Associação Americana de Bancos de Sangue, pp. 53-38.
2.Hansen JH,et al.Interferência de HAMA com imunoensaios baseados em anticorpos monoclonais murinos[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS.A natureza dos anticorpos heterofílicos e o papel na interferência do imunoensaio[J].J of Clin Immunoassay,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, et al. (1978) Agente transmissível na hepatite não-A, não-B. Lancet I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Vírus da Hepatite C: o principal agente causador da hepatite viral não A, não B. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Ensaio imunoenzimático (ELISA): ensaio qualitativo de IgG. Imunoquímica 8:871-874.
VALORES ESPERADOS
HCV-Ab<0,02
Recomenda-se que cada laboratório estabeleça sua própria faixa normal representando sua população de pacientes.
RESULTADOS E INTERPRETAÇÃO DOS TESTES
- Os dados acima são o resultado do teste de reagente para anticorpos contra o HCV, e sugere-se que cada laboratório estabeleça uma faixa de valores de detecção de anticorpos contra o HCV adequada para a população da região. Os resultados acima são apenas para referência.
- Os resultados deste método são aplicáveis apenas às faixas de referência estabelecidas neste método, e não há comparabilidade direta com outros métodos.
- Outros fatores também podem causar erros nos resultados de detecção, incluindo razões técnicas, erros operacionais e outros fatores de amostra.
ARMAZENAMENTO E ESTABILIDADE
- O kit tem validade de 18 meses a partir da data de fabricação. Armazene os kits não utilizados entre 2 e 30 °C. NÃO CONGELE. Não use após a data de validade.
- Não abra a embalagem lacrada até que esteja pronto para realizar um teste. Recomenda-se que o teste de uso único seja usado no ambiente necessário (temperatura de 2 a 35 ℃, umidade de 40 a 90%) dentro de 60 minutos, o mais rápido possível.
- O diluente da amostra é usado imediatamente após ser aberto.
AVISOS E PRECAUÇÕES
O kit deve ser selado e protegido contra umidade.
.Todas as amostras positivas devem ser validadas por outras metodologias.
.Todos os espécimes devem ser tratados como poluentes potenciais.
.NÃO utilize reagente vencido.
.NÃO troque reagentes entre kits com números de lote diferentes.
.NÃO reutilize cartões de teste e quaisquer acessórios descartáveis.
.Operação incorreta, amostra excessiva ou pequena podem levar a desvios nos resultados.
LIMITAÇÃO
.Como em qualquer ensaio que utiliza anticorpos de camundongo, existe a possibilidade de interferência de anticorpos humanos anti-camundongo (HAMA) na amostra. Amostras de pacientes que receberam preparações de anticorpos monoclonais para diagnóstico ou terapia podem conter HAMA. Essas amostras podem causar resultados falso-positivos ou falso-negativos.
Legenda dos símbolos utilizados:
 | Dispositivo Médico de Diagnóstico In Vitro |
 | Fabricante |
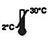 | Armazene entre 2 e 30 ℃ |
 | Data de validade |
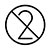 | Não Reutilizar |
 | CUIDADO |
 | Consulte as instruções de uso |