Nowa dostawa dla Chin Zestaw do testu na choroby zakaźne HBV (HBSAG HIV HCV, HBCAB HBEAG HBEAB HBCAB) Zestaw do szybkiej diagnostyki HBsAb/Kaseta z paskiem testowym na przeciwciała powierzchniowe HBsAb wirusa zapalenia wątroby typu B
Niezwykle bogate doświadczenie w zarządzaniu projektami i model obsługi klienta od osoby do osoby sprawiają, że komunikacja w organizacji i nasze łatwe zrozumienie Państwa oczekiwań w zakresie nowej dostawy dla chińskich zestawów testowych na choroby zakaźne HBV (HBSAG HIV HCV, HBCAB HBEAG HBEAB HBCAB) zestawu do szybkiej diagnostyki HBsAb/kasety pasków testowych na przeciwciała powierzchniowe HBsAb wirusa zapalenia wątroby typu B. Dzięki szerokiej gamie produktów, najwyższej jakości, rozsądnym cenom i stylowemu wzornictwu nasze produkty są szeroko stosowane w tej i innych branżach.
Niezwykle bogate doświadczenie w zarządzaniu projektami oraz model obsługi „od osoby do osoby” sprawiają, że komunikacja w organizacji i łatwe zrozumienie Państwa oczekiwań mają ogromne znaczenie.Chiny Wirusowe zapalenie wątroby typu B, Zestaw testowy HBsAbJeśli podasz nam listę produktów, którymi jesteś zainteresowany, wraz z markami i modelami, możemy przesłać Ci wyceny. Prosimy o bezpośredni kontakt mailowy. Naszym celem jest budowanie długoterminowych i wzajemnie korzystnych relacji biznesowych z klientami krajowymi i zagranicznymi. Czekamy na Twoją odpowiedź.
Wyłącznie do diagnostyki in vitro
Przed użyciem należy uważnie przeczytać ulotkę dołączoną do opakowania i ściśle przestrzegać instrukcji. Nie można zagwarantować wiarygodności wyników testu w przypadku jakichkolwiek odstępstw od instrukcji zawartych w ulotce.
PRZEZNACZENIE
Zestaw diagnostyczny do oznaczania przeciwciał wirusa zapalenia wątroby typu C (test immunochromatograficzny fluorescencyjny) to test immunochromatograficzny fluorescencyjny do ilościowego oznaczania przeciwciał przeciwko wirusowi HCV w surowicy lub osoczu krwi ludzkiej, co stanowi istotną wartość pomocniczą w diagnostyce zakażenia wirusem zapalenia wątroby typu C. Wszystkie dodatnie wyniki próbek muszą zostać potwierdzone innymi metodami. Test jest przeznaczony wyłącznie do użytku przez pracowników służby zdrowia.
1. Odłóż wszystkie odczynniki i próbki, aby osiągnęły temperaturę pokojową.
2. Otwórz przenośny analizator odporności (WIZ-A101), wprowadź hasło logowania zgodnie z metodą obsługi urządzenia i przejdź do interfejsu wykrywania.
3. Zeskanuj kod identyfikacyjny, aby potwierdzić przedmiot testowy.
4. Wyjmij kartę testową z torebki foliowej.
5. Włóż kartę testową do gniazda na kartę, zeskanuj kod QR i określ element testowy.
6. Dodać 20 μL próbki surowicy lub osocza do rozcieńczalnika i dobrze wymieszać.
7. Dodać 80 μl roztworu próbki do studzienki próbki na karcie.
8. Kliknij przycisk „standardowy test”. Po 15 minutach urządzenie automatycznie wykryje kartę testową, odczyta wyniki z ekranu wyświetlacza urządzenia i zapisze/wydrukuje wyniki testu.
9. Zapoznaj się z instrukcją obsługi przenośnego analizatora odporności (WIZ-A101).
STRESZCZENIE
Wirus zapalenia wątroby typu C (HCV) to otoczkowy, jednoniciowy wirus o dodatnim sensie RNA (9,5 kb) należący do rodziny Flaviviridae. Zidentyfikowano sześć głównych genotypów i serii podtypów HCV. Wyizolowany w 1989 roku, HCV jest obecnie uznawany za główną przyczynę zapalenia wątroby typu non-A, non-B związanego z transfuzją. Choroba charakteryzuje się postacią ostrą i przewlekłą. U ponad 50% zakażonych osób rozwija się ciężkie, zagrażające życiu przewlekłe zapalenie wątroby z marskością wątroby i rakiem wątrobowokomórkowym. Od czasu wprowadzenia w 1990 roku badań przesiewowych krwi dawców na obecność przeciwciał przeciwko HCV, częstość występowania tego zakażenia u biorców transfuzji została znacznie zmniejszona. Badania kliniczne pokazują, że znaczna liczba osób zakażonych HCV wytwarza przeciwciała przeciwko niestrukturalnemu białku NS5 wirusa. W tym celu testy obejmują antygeny z regionu NS5 genomu wirusa, a także NS3 (c200), NS4 (c200) i Core (c22).
ZASADA POSTĘPOWANIA
Membrana urządzenia testowego jest pokryta antygenem HCV w obszarze testowym oraz kozim przeciwciałem antykróliczym IgG w obszarze kontrolnym. Etykieta jest uprzednio pokryta znakowanym fluorescencyjnie antygenem HCV i króliczym IgG. Podczas badania próbki dodatniej, przeciwciała HCV w próbce łączą się ze znakowanym fluorescencyjnie antygenem HCV, tworząc mieszaninę immunologiczną. Pod wpływem immunochromatografii kompleks przemieszcza się w kierunku bibuły chłonnej. Po przejściu przez obszar testowy, kompleks łączy się z antygenem powlekającym HCV, tworząc nowy kompleks. Poziom przeciwciał HCV jest dodatnio skorelowany z sygnałem fluorescencyjnym, a stężenie przeciwciał HCV w próbce można wykryć za pomocą immunoanalizy fluorescencyjnej.
DOSTARCZONE ODCZYNNIKI I MATERIAŁY
Komponenty pakietu 25T:
Karta testowa w indywidualnym woreczku foliowym z pochłaniaczem wilgoci
.Rozcieńczalniki do próbek
Ulotka dołączona do opakowania
MATERIAŁY WYMAGANE, ALE NIE DOSTARCZONE
Pojemnik do pobierania próbek, timer
POBIERANIE I PRZECHOWYWANIE PRÓBEK
1. Badanymi próbkami mogą być surowica, osocze z antykoagulantem heparyny lub osocze z antykoagulantem EDTA.
2. Pobrać próbkę zgodnie ze standardowymi technikami. Próbkę surowicy lub osocza można przechowywać w lodówce w temperaturze 2-8°C przez 7 dni, a następnie kriokonserwować w temperaturze poniżej -15°C przez 6 miesięcy.
3.Wszystkie próbki należy poddawać cyklom zamrażania i rozmrażania.
PROCEDURA BADANIA
Przed przystąpieniem do testów należy zapoznać się z instrukcją obsługi urządzenia oraz ulotką dołączoną do opakowania.
Wynik tego testu służy wyłącznie celom klinicznym i nie powinien być jedyną podstawą diagnozy klinicznej ani leczenia. Opieka kliniczna nad pacjentem powinna być kompleksowa i obejmować obserwację objawów, historię choroby, inne badania laboratoryjne, reakcję na leczenie, dane epidemiologiczne i inne informacje.
Ten odczynnik jest przeznaczony wyłącznie do badań surowicy i osocza. Może nie dać dokładnych wyników w przypadku innych próbek, takich jak ślina, mocz itp.
CHARAKTERYSTYKA WYDAJNOŚCI
| Liniowość | 0,005-5 | odchylenie względne: -15% do +15%. |
| Współczynnik korelacji liniowej: (r) ≥ 0,9900 | ||
| Dokładność | Wskaźnik odzysku powinien mieścić się w granicach 85% – 115%. | |
| Powtarzalność | Współczynnik zmienności ≤15% | |
ODNIESIENIA
1. Zapalenie wątroby po transfuzji. W: Moore SB, red. Choroby wirusowe przenoszone drogą transfuzji. Alington, VA. Am. Assoc. Banki krwi, s. 53-38.
2.Hansen JH i in.Interferencja HAMA z testami immunologicznymi opartymi na przeciwciałach monoklonalnych myszy[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS. Natura przeciwciał heterofilowych i ich rola w interferencji z immunoanalizą [J].J of Clin Immunoassay,1992,15:108-114.
4. Alter HJ., Purcell RH, Holland PV i wsp. (1978) Czynnik przenoszony w zapaleniu wątroby typu nie-A, nie-B. Lancet I: 459-463.
5.Choo QL,Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Wirus zapalenia wątroby typu C: główny czynnik wywołujący wirusowe zapalenie wątroby typu nie-A, nie-B. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Test immunoenzymatyczny (ELISA): jakościowy test IgG. Immunochemia 8:871-874.
WARTOŚCI OCZEKIWANE
HCV-Ab<0,02
Zaleca się, aby każde laboratorium ustaliło własny zakres normy dla swojej populacji pacjentów.
WYNIKI TESTÓW I INTERPRETACJA
- Powyższe dane pochodzą z testu odczynnikowego na obecność przeciwciał HCV-Ab i zaleca się, aby każde laboratorium ustaliło zakres wartości wykrywalności przeciwciał HCV-Ab odpowiedni dla populacji w tym regionie. Powyższe wyniki mają charakter wyłącznie poglądowy.
- Wyniki uzyskane tą metodą odnoszą się wyłącznie do zakresów odniesienia ustalonych w tej metodzie i nie ma możliwości bezpośredniego porównania ich z innymi metodami.
- Inne czynniki mogą również powodować błędy w wynikach wykrywania, w tym przyczyny techniczne, błędy operacyjne i inne czynniki związane z próbką.
PRZECHOWYWANIE I STABILNOŚĆ
- Zestaw ma 18-miesięczny okres przydatności od daty produkcji. Niewykorzystane zestawy należy przechowywać w temperaturze 2-30°C. NIE ZAMRAŻAĆ. Nie używać po upływie terminu ważności.
- Nie otwieraj zamkniętej torebki, dopóki nie będziesz gotowy do wykonania testu. Zaleca się, aby jednorazowy test wykonać w wymaganych warunkach (temperatura 2–35℃, wilgotność 40–90%) w ciągu 60 minut tak szybko, jak to możliwe.
- Rozcieńczalnik do próbek należy zużyć natychmiast po otwarciu.
OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI
Zestaw powinien być szczelnie zamknięty i zabezpieczony przed wilgocią.
Wszystkie pozytywne próbki muszą zostać potwierdzone innymi metodami.
.Wszystkie próbki należy traktować jako potencjalne zanieczyszczenie.
.NIE stosować przeterminowanego odczynnika.
.NIE zamieniaj odczynników między zestawami o różnych numerach partii.
.NIE używaj ponownie kart testowych ani żadnych akcesoriów jednorazowego użytku.
.Niewłaściwa obsługa, nadmierna lub zbyt mała próbka mogą prowadzić do odchyleń wyników.
LIMITACJA
.Podobnie jak w przypadku każdego testu wykorzystującego przeciwciała mysie, istnieje możliwość interferencji ze strony ludzkich przeciwciał antymysich (HAMA) w próbce. Próbki pobrane od pacjentów, którym podano preparaty przeciwciał monoklonalnych w celach diagnostycznych lub terapeutycznych, mogą zawierać HAMA. Takie próbki mogą dawać wyniki fałszywie dodatnie lub fałszywie ujemne.
Legenda użytych symboli:
 | Wyrób medyczny do diagnostyki in vitro |
 | Producent |
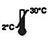 | Przechowywać w temperaturze 2–30℃ |
 | Data ważności |
 | Nie używać ponownie |
 | OSTROŻNOŚĆ |
 | Zapoznaj się z instrukcją użytkowania |