Kit Diagnostik untuk Antibodi Virus Hepatitis C (Ujian Imunokromatografi Pendarfluor)
Untuk kegunaan diagnostik in vitro sahaja
Sila baca sisipan pakej ini dengan teliti sebelum digunakan dan ikut arahan dengan ketat. Kebolehpercayaan keputusan ujian tidak dapat dijamin jika terdapat sebarang penyimpangan daripada arahan dalam sisipan pakej ini.
PENGGUNAAN YANG DITUJUKAN
Kit Diagnostik untuk Antibodi Virus Hepatitis C (Ujian Imunokromatografi Pendarfluor) ialah ujian imunokromatografi pendarfluor untuk pengesanan kuantitatif antibodi HCV dalam serum atau plasma manusia, yang merupakan nilai diagnostik tambahan yang penting untuk jangkitan hepatitis C. Semua sampel positif mesti disahkan oleh metodologi lain. Ujian ini bertujuan untuk kegunaan profesional penjagaan kesihatan sahaja.
1. Ketepikan semua reagen dan sampel pada suhu bilik.
2. Buka Penganalisis Imun Mudah Alih (WIZ-A101), masukkan kata laluan akaun log masuk mengikut kaedah operasi instrumen, dan masukkan antara muka pengesanan.
3. Imbas kod pengesahan untuk mengesahkan item ujian.
4. Keluarkan kad ujian dari beg kerajang.
5. Masukkan kad ujian ke dalam slot kad, imbas kod QR dan tentukan item ujian.
6. Masukkan 20μL sampel serum atau plasma ke dalam pelarut sampel, dan gaul rata.
7. Tambahkan 80μL larutan sampel ke dalam perigi sampel kad.
8. Klik butang “ujian standard”, selepas 15 minit, instrumen akan mengesan kad ujian secara automatik, ia boleh membaca keputusan daripada skrin paparan instrumen dan merekod/mencetak keputusan ujian.
9. Rujuk arahan Penganalisis Imun Mudah Alih (WIZ-A101).
RINGKASAN
Virus Hepatitis C (HCV) ialah virus RNA deria positif terkandas tunggal (9.5 kb) yang merupakan sampul surat dan tergolong dalam keluarga Flaviviridae. Enam genotip utama dan siri subjenis HCV telah dikenal pasti. Diasingkan pada tahun 1989, HCV kini diiktiraf sebagai punca utama hepatitis bukan A dan bukan B yang berkaitan dengan transfusi. Penyakit ini dicirikan dengan bentuk akut dan kronik. Lebih daripada 50% individu yang dijangkiti menghidap hepatitis kronik yang teruk dan mengancam nyawa dengan sirosis hati dan karsinoma hepatoselular. Sejak pengenalan saringan anti-HCV terhadap derma darah pada tahun 1990, kejadian jangkitan ini dalam kalangan penerima transfusi telah berkurangan dengan ketara. Kajian klinikal menunjukkan bahawa sejumlah besar individu yang dijangkiti HCV membentuk antibodi terhadap protein bukan struktur NS5 virus tersebut. Untuk ini, ujian tersebut merangkumi antigen daripada kawasan NS5 genom virus selain NS3 (c200), NS4 (c200) dan Core (c22).
PRINSIP PROSEDUR
Membran peranti ujian disalut dengan antigen HCV pada kawasan ujian dan antibodi IgG anti-arnab kambing pada kawasan kawalan. Pad label disalut dengan antigen HCV berlabel pendarfluor dan IgG arnab terlebih dahulu. Apabila menguji sampel positif, antibodi HCV dalam sampel bergabung dengan antigen HCV berlabel pendarfluor, dan membentuk campuran imun. Di bawah tindakan imunokromatografi, aliran kompleks ke arah kertas penyerap, apabila kompleks melepasi kawasan ujian, ia bergabung dengan antigen salutan antigen HCV, membentuk kompleks baharu. Tahap antibodi HCV berkorelasi positif dengan isyarat pendarfluor, dan kepekatan antibodi HCV dalam sampel boleh dikesan melalui ujian imunoasai pendarfluor.
REAGEN DAN BAHAN YANG DIBEKALKAN
Komponen pakej 25T:
Kad ujian secara individu di dalam kerajang yang dibungkus dengan bahan pengering
.Pencair sampel
Sisipan pakej
BAHAN YANG DIPERLUKAN TETAPI TIDAK DISEDIAKAN
Bekas pengumpulan sampel, pemasa
PENGUMPULAN DAN PENYIMPANAN SAMPEL
1. Sampel yang diuji boleh terdiri daripada serum, plasma antikoagulan heparin atau plasma antikoagulan EDTA.
2. Mengikut teknik standard, kumpulkan sampel. Sampel serum atau plasma boleh disimpan di dalam peti sejuk pada suhu 2-8℃ selama 7 hari dan kriopengawetan di bawah -15°C selama 6 bulan.
3. Semua sampel mengelakkan kitaran beku-cair.
PROSEDUR PENGUJIAN
Sila baca manual operasi instrumen dan sisipan pakej sebelum menguji.
Keputusan ujian ini hanya untuk rujukan klinikal, tidak sepatutnya menjadi satu-satunya asas untuk diagnosis dan rawatan klinikal, pengurusan klinikal pesakit harus dipertimbangkan secara komprehensif digabungkan dengan simptomnya, sejarah perubatan, pemeriksaan makmal lain, tindak balas rawatan, epidemiologi dan maklumat lain.
Reagen ini hanya digunakan untuk ujian serum dan plasma. Ia mungkin tidak memberikan keputusan yang tepat apabila digunakan untuk sampel lain seperti air liur dan air kencing dan sebagainya.
CIRI-CIRI PRESTASI
| Lineariti | 0.005-5 | sisihan relatif:-15% hingga +15%. |
| Pekali korelasi linear:(r)≥0.9900 | ||
| Ketepatan | Kadar pemulihan hendaklah dalam lingkungan 85% – 115%. | |
| Kebolehulangan | CV≤15% | |
RUJUKAN
1. Hepatitis selepas transfusi. Dalam: Moore SB, penyunting. Penyakit Virus yang Dijangkiti Transfusi. Alington, VA. Am. Assoc. Bank Darah, ms. 53-38.
2.Hansen JH, dkk. Gangguan HAMA dengan Ujian Imunoasai Berasaskan Antibodi Monoklonal Murine[J].J daripada Ujian Imunoasai Klinikal,1993,16:294-299.
3.Levinson SS. Sifat Antibodi Heterofilik dan Peranan dalam Gangguan Ujian Imuno[J].J daripada Ujian Imuno Clin,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, dkk. (1978) Agen berjangkit dalam hepatitis bukan-A, bukan-B. Lancet I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus Hepatitis C: agen penyebab utama hepatitis virus bukan A, bukan B. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Ujian imunosorben berkaitan enzim (ELISA): ujian kualitatif IgG. Imunokimia 8:871-874.
NILAI YANG DIJANGKA
HCV-Ab<0.02
Adalah disyorkan agar setiap makmal menetapkan julat normalnya sendiri yang mewakili populasi pesakitnya.
KEPUTUSAN UJIAN DAN INTERPRETASI
- Data di atas adalah hasil ujian reagen HCV-Ab, dan adalah dicadangkan agar setiap makmal menetapkan julat nilai pengesanan HCV-Ab yang sesuai untuk populasi di rantau ini. Keputusan di atas hanyalah untuk rujukan.
- Keputusan kaedah ini hanya terpakai kepada julat rujukan yang ditetapkan dalam kaedah ini, dan tiada perbandingan langsung dengan kaedah lain.
- Faktor lain juga boleh menyebabkan ralat dalam keputusan pengesanan, termasuk sebab teknikal, ralat operasi dan faktor sampel lain.
PENYIMPANAN DAN KESTABILAN
- Kit ini tahan selama 18 bulan dari tarikh pembuatan. Simpan kit yang tidak digunakan pada suhu 2-30°C. JANGAN BEKUKAN. Jangan gunakan selepas tarikh luput.
- Jangan buka kantung yang telah ditutup rapat sehingga anda bersedia untuk menjalankan ujian, dan ujian guna sekali sahaja dicadangkan untuk digunakan di bawah persekitaran yang diperlukan (suhu 2-35℃, kelembapan 40-90%) dalam masa 60 minit secepat mungkin.
- Pelarut sampel digunakan sebaik sahaja dibuka.
AMARAN DAN LANGKAH BERJAGA-JAGA
Kit hendaklah ditutup rapat dan dilindungi daripada kelembapan.
Semua spesimen positif hendaklah disahkan melalui metodologi lain.
.Semua spesimen hendaklah dianggap sebagai bahan pencemar yang berpotensi.
.JANGAN gunakan reagen yang telah tamat tempoh.
.JANGAN tukar reagen antara kit dengan No. lot yang berbeza.
.JANGAN gunakan semula kad ujian dan sebarang aksesori pakai buang.
.Salah operasi, sampel yang berlebihan atau sedikit boleh menyebabkan penyimpangan keputusan.
LIMITASI
.Seperti mana-mana ujian yang menggunakan antibodi tikus, terdapat kemungkinan gangguan oleh antibodi anti-tikus manusia (HAMA) dalam spesimen. Spesimen daripada pesakit yang telah menerima persediaan antibodi monoklonal untuk diagnosis atau terapi mungkin mengandungi HAMA. Spesimen sedemikian boleh menyebabkan keputusan positif palsu atau negatif palsu.
Kunci kepada simbol yang digunakan:
 | Peranti Perubatan Diagnostik In Vitro |
 | Pengilang |
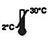 | Simpan pada suhu 2-30℃ |
 | Tarikh Luput |
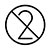 | Jangan Guna Semula |
 | AWAS |
 | Rujuk Arahan Penggunaan |