Diagnostikkit fir Antikörper géint Helicobacter Pylori (Fluoreszenz Immunochromatographic Assay)
Diagnostikkit fir Antikörper géint Helicobacter Pylori(Fluoreszenz-Immunochromatographesch Assay)
Nëmme fir in-vitro-Diagnostik
Liest w.e.g. dëse Packungsbeilage virsiichteg ier Dir d'Medikament benotzt a befollegt d'Instruktioune strikt. D'Zouverlässegkeet vun den Testergebnisse kann net garantéiert ginn, wa vun den Instruktioune an dësem Packungsbeilage ofwäicht.
GEWICHTEG BENOTZUNG
Den Diagnostikkit fir Antikörper géint Helicobacter Pylori (Fluoreszenz-Immunochromatographesch Assay) ass e Fluoreszenz-Immunochromatographeschen Assay fir d'quantitativ Noweis vun HP-Antikörper am mënschleche Serum oder Plasma. Dëst ass e wichtegen zousätzleche diagnostesche Wäert fir Mageninfektiounen. All positiv Proben mussen duerch aner Methoden bestätegt ginn. Dësen Test ass nëmme fir de Gebrauch duerch Gesondheetsspezialisten geduecht.
ZESUMMEFAASSUNG
D'Infektioun mat der Helicobacter pylori (Helicobacter pylori) am Magen ass enk verbonnen mat chronescher Gastritis, Magengeschwür, Magenadenokarzinom, Lymphom assoziéiert mat der Magenschleimhaut, an enger H. pylori-Infektiounsquote vu ronn 90% bei Patienten mat Gastritis, Magengeschwür, Darmgeschwür a Magenkriibs. D'WHO huet H. pylori als den éischten Typ vu Kriibsverursachende Faktor identifizéiert. Et ass e Risikofaktor fir Magenkriibs. D'Detektioun vun H. pylori ass vu grousser Bedeitung bei der Diagnos vun enger H. pylori-Infektioun.
PRINZIP VUN DER PROZEDUR
D'Membran vum Testgerät ass mat HP-Antigen op der Testregioun an engem Geess-Anti-Kanéngchen-IgG-Antikörper op der Kontrollregioun beschichtet. D'Etikettpads sinn am Viraus mat fluoreszenzmarkéiertem HP-Antigen a Kanéngchen-IgG beschichtet. Wann eng positiv Prouf getest gëtt, verbënnt sech den HP-Antikörper an der Prouf mam fluoreszenzmarkéierten HP-Antigen a bildt eng Immunmëschung. Ënnert der Aktioun vun der Immunochromatographie fléisst de Komplex a Richtung vum absorbéierende Pabeier. Wann de Komplex d'Testregioun passéiert, verbënnt sech mat dem HP-Beschichtungsantigen a bildt en neie Komplex. Den HP-Ab-Niveau korreléiert positiv mam Fluoreszenzsignal, an d'Konzentratioun vun HP-Ab an der Prouf kann duerch e Fluoreszenz-Immunoassay festgestallt ginn.
GELIEWERT REAGENTIEN A MATERIAL
25T Pakkomponenten:
Testkaart eenzel an Foliebeutel mat engem Trockner 25T
Proufverdënnungsmëttel 25T
Pakungsbeilage 1
NÉIDEG MATERIALER, DÉI AWER NET LEEGGEBRAUCH GINN
Proufsammlungsbehälter, Timer
PROBESAMMELUNG A LAGERUNG
1. Déi geteste Prouwe kënne Serum, Heparin-Antikoagulantplasma oder EDTA-Antikoagulantplasma sinn.
2. No Standardtechnike soll d'Prouf geholl ginn. D'Serum- oder Plasmaprouf kann 7 Deeg am Frigo bei 2-8 ℃ an 6 Méint bei enger Kryokonservéierung ënner -15 °C gelagert ginn.
3. All Prouf vermeit Gefrier-Optau-Zyklen.
ASSAY-PROCEDUR
Liest w.e.g. d'Bedienungsanleitung an d'Verpackungsbeilage vum Instrument ier Dir den Test maacht.
1. Leet all Reagenzien a Proben op Raumtemperatur.
2. Maacht den portablen Immunanalysator (WIZ-A101) op, gitt de Login-Passwuert vum Kont no der Operatiounsmethod vum Instrument an, a gitt an d'Detektiounsinterface.
3. Scannt den Dentifikatiounscode fir den Testartikel ze bestätegen.
4. Huelt d'Testkaart aus der Foliebeutel eraus.
5. Setzt d'Testkaart an de Kaarteschlitz, scannt de QR-Code a bestëmmt den Testartikel.
6. Füügt 20 μL Serum- oder Plasmaprouf zum Proufverdünnungsmëttel bäi a vermëscht gutt.
7. Gidd 80 μL Proufléisung an de Proufschacht vun der Kaart bäi.
8. Klickt op de Knäppchen "Standardtest". No 15 Minutten erkennt den Instrument automatesch d'Testkaart, et kann d'Resultater vum Bildschierm vum Instrument liesen an d'Testergebnisse ophuelen/drécken.
9. Kuckt d'Instruktioune vum Portable Immune Analyzer (WIZ-A101).
ERWARDET WÄERTER
HP-Ab<10
Et ass recommandéiert, datt all Laboratoire säin eegenen Normalberäich festleet, deen seng Patientenpopulatioun representéiert.
TESTRESULTATER AN INTERPRETATIOUN
Déi uewe genannten Donnéeën sinn d'Resultat vum HP-Ab Reagens Test, an et gëtt virgeschloen, datt all Laboratoire eng Palette vun HP-Ab Detektiounswäerter festleet, déi fir d'Bevëlkerung an dëser Regioun gëeegent sinn. Déi uewe genannten Resultater sinn nëmme fir Referenz.
D'Resultater vun dëser Method sinn nëmme fir d'Referenzberäicher uwendbar, déi an dëser Method festgeluecht goufen, an et gëtt keng direkt Vergläichbarkeet mat anere Methoden.
Aner Faktoren kënnen och Feeler an den Detektiounsresultater verursaachen, dorënner technesch Grënn, operationell Feeler an aner Prouffaktoren.
LAGERUNG A STABILITÉIT
1. De Kit ass 18 Méint nom Produktiounsdatum haltbar. Ongebraucht Kits bei 2-30°C lageren. NET AFFRIEREN. Net no dem Verfallsdatum benotzen.
2. Maacht déi zoue Täsch net op, bis Dir prett sidd fir en Test duerchzeféieren, an et ass recommandéiert, den Eenwegtest ënner der gewënschter Ëmwelt (Temperatur 2-35 ℃, Fiichtegkeet 40-90%) bannent 60 Minutten sou séier wéi méiglech ze benotzen.
3. De Proufverdënnungsmëttel gëtt direkt nom Opmaache benotzt.
WARNUNGEN A VIRSIICHTSMOOSNAMEN
De Kit soll versiegelt a géint Fiichtegkeet geschützt sinn.
All positiv Prouwe mussen duerch aner Methodologien validéiert ginn.
All Prouwe solle wéi potenziell Schadstoff behandelt ginn.
Benotzt keen ofgelafenen Reagens.
Tauscht keng Reagenzien tëscht Kits mat verschiddenen Chargennummeren aus.
Testkaarten an all Accessoiren fir ewechzegeheien NET nei benotzen.
Falsch Operatioun, exzessiv oder kleng Prouf kënnen zu Ofwäichunge vum Resultat féieren.
LIMITATIOUN
Wéi bei all Tester, déi Mausantikörper benotzen, besteet d'Méiglechkeet vun enger Interferenz duerch mënschlech Anti-Mausantikörper (HAMA) an der Prouf. Prouwe vu Patienten, déi Virbereedunge vu monoklonalen Antikörper fir Diagnos oder Therapie kritt hunn, kënnen HAMA enthalen. Sou Prouwe kënne falsch positiv oder falsch negativ Resultater verursaachen.
Dëst Testergebnis ass nëmme fir klinesch Zwecker geduecht a soll net als eenzeg Basis fir eng klinesch Diagnos a Behandlung déngen. D'klinesch Gestioun vum Patient soll ëmfaassend berécksiichtegt ginn, zesumme mat senge Symptomer, senger medizinescher Geschicht, anere Laboruntersuchungen, senger Äntwert op d'Behandlung, senger Epidemiologie an aneren Informatiounen.
Dëse Reagens gëtt nëmme fir Serum- a Plasmatester benotzt. Et kann sinn, datt et keng genee Resultater gëtt, wann et fir aner Proben, wéi z. B. Spaut an Urin, benotzt gëtt.
Leeschtungseigenschaften
| Linearitéit | 10-1000 | relativ Ofwäichung: -15% bis +15%. |
| Lineare Korrelatiounskoeffizient: (r) ≥ 0,9900 | ||
| Genauegkeet | D'Erhuelungsquote soll tëscht 85% an 115% leien. | |
| Widderhuelbarkeet | CV≤15% | |
RREFERENZEN
1. Shao, JL&F. Wu. Rezent Fortschrëtter bei den Detektiounsmethoden vun Helicobacter pylori [J]. Journal of Gastroenterology and Hepatology, 2012, 21 (8): 691-694
2. Hansen JH, et al. HAMA-Interferenz mat murine monoklonalen Antikörper-baséierten Immunoassays [J]. J of Clin Immunoassay, 1993, 16: 294-299.
3. Levinson SS. D'Natur vun heterophilen Antikörper an d'Roll an der Immunoassay-Interferenz [J]. J of Clin Immunoassay, 1992, 15: 108-114.
Legend vun de benotzte Symboler:
 | In-vitro-Diagnostesch Medizinprodukt |
 | Hiersteller |
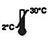 | Späicheren bei 2-30 ℃ |
 | Auslafdatum |
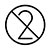 | Net nei benotzen |
 | OPGEPASST |
 | Consultéiert d'Benotzungsinstruktiounen |
Xiamen Wiz Biotech CO., LTD
Adress: 3.-4. Stack, Gebai Nr. 16, Biomedizinescht Atelier, 2030 Wengjiao West Road, Distrikt Haicang, 361026, Xiamen, China
Tel.: +86-592-6808278
Fax: +86-592-6808279