Nova entrega para o kit de probas de VHB de enfermidades infecciosas da China (HBSAG VIH VHC, HBCAB HBEAG HBEAB HBCAB) Kit de proba de diagnóstico rápido HBsAb/Casete de tiras de proba de anticorpos superficiais da hepatite B HBsAb
As experiencias incriblemente ricas en administración de proxectos e o modelo de servizo individual fan que a comunicación entre as organizacións sexa fundamental e que comprendamos facilmente as súas expectativas para a nova entrega do kit de probas do VHB de enfermidades infecciosas de China (HBSAG VIH VHC, HBCAB HBEAG HBEAB HBCAB) Kit de probas de diagnóstico rápido HBsAb/Casete de tiras de proba de anticorpos de superficie da hepatite B HBsAb. Cunha ampla gama, alta calidade, prezos razoables e deseños elegantes, os nosos produtos úsanse amplamente nestas e outras industrias.
As experiencias incriblemente ricas en administración de proxectos e o modelo de servizo individual fan que a comunicación organizativa sexa fundamental e que comprendamos facilmente as vosas expectativas.Hepatite B chinesa, Kit de proba de HBsAbSe nos proporciona unha lista de produtos que lle interesan, xunto coas marcas e os modelos, podemos enviarlle orzamentos. Envíenos un correo electrónico directamente. O noso obxectivo é establecer relacións comerciais a longo prazo e mutuamente rendibles con clientes nacionais e estranxeiros. Agardamos recibir a súa resposta en breve.
Só para uso en diagnóstico in vitro
Lea atentamente este prospecto antes de usalo e siga estritamente as instrucións. Non se pode garantir a fiabilidade dos resultados do ensaio se hai algunha desviación das instrucións deste prospecto.
USO PREVISTO
O kit de diagnóstico para anticorpos contra o virus da hepatite C (ensaio inmunocromatográfico de fluorescencia) é un ensaio inmunocromatográfico de fluorescencia para a detección cuantitativa de anticorpos contra o VHC no soro ou plasma humano, que ten un valor diagnóstico auxiliar importante para a infección por hepatite C. Todas as mostras positivas deben confirmarse con outras metodoloxías. Esta proba está destinada só para uso profesional sanitario.
1. Deixar de lado todos os reactivos e as mostras á temperatura ambiente.
2. Abra o analizador inmunitario portátil (WIZ-A101), introduza o contrasinal de inicio de sesión da conta segundo o método de funcionamento do instrumento e acceda á interface de detección.
3. Escanee o código de identificación para confirmar o elemento de proba.
4. Saque a tarxeta de proba da bolsa de aluminio.
5. Insira a tarxeta de proba na ranura para tarxetas, escanee o código QR e determine o elemento de proba.
6. Engadir 20 μL de mostra de soro ou plasma ao diluínte da mostra e mesturar ben.
7. Engadir 80 μL de solución de mostra ao pozo de mostra da tarxeta.
8. Fai clic no botón "proba estándar". Despois de 15 minutos, o instrumento detectará automaticamente a tarxeta de proba, poderá ler os resultados na pantalla do instrumento e rexistrar/imprimir os resultados da proba.
9. Consulte as instrucións do analizador inmunitario portátil (WIZ-A101).
RESUMO
O virus da hepatite C (VHC) é un virus de ARN monocatenario de sentido positivo (9,5 kb) con envoltura que pertence á familia Flaviviridae. Identificáronse seis xenotipos principais e series de subtipos de VHC. Illado en 1989, o VHC recoñécese agora como a principal causa de hepatite non A e non B asociada a transfusións. A enfermidade caracterízase por formas agudas e crónicas. Máis do 50 % dos individuos infectados desenvolven hepatite crónica grave e potencialmente mortal con cirrose hepática e carcinomas hepatocelulares. Desde a introdución en 1990 da detección anti-VHC nas doazóns de sangue, a incidencia desta infección en receptores de transfusións reduciuse significativamente. Os estudos clínicos mostran que unha cantidade significativa de individuos infectados polo VHC desenvolven anticorpos contra a proteína non estrutural NS5 do virus. Para iso, as probas inclúen antíxenos da rexión NS5 do xenoma viral, ademais de NS3 (c200), NS4 (c200) e Core (c22).
PRINCIPIO DO PROCEDEMENTO
A membrana do dispositivo de proba está recuberta con antíxeno do VHC na rexión de proba e anticorpo IgG de cabra anti-coello na rexión de control. As almofadas da etiqueta están recubertas previamente con antíxeno do VHC marcado con fluorescencia e IgG de coello. Ao analizar unha mostra positiva, o anticorpo do VHC na mostra combínase co antíxeno do VHC marcado con fluorescencia e forma unha mestura inmunitaria. Baixo a acción da inmunocromatografía, o complexo flúe na dirección do papel absorbente; cando o complexo pasa pola rexión de proba, combínase co antíxeno de revestimento do antíxeno do VHC, formando un novo complexo. O nivel de anticorpos do VHC está correlacionado positivamente co sinal de fluorescencia e a concentración de anticorpos do VHC na mostra pódese detectar mediante un ensaio inmunolóxico de fluorescencia.
REACTIVOS E MATERIAIS FORNECIDOS
Compoñentes do paquete de 25T:
Tarxeta de proba individualmente en bolsa de aluminio cun desecante
Diluíntes de mostras
.Prospecto do paquete
MATERIAIS NECESARIOS PERO NON FORNECIDOS
Recipiente de recollida de mostras, temporizador
RECOLLIDA E ALMACENAMENTO DE MOSTRAS
1. As mostras analizadas poden ser soro, plasma anticoagulante con heparina ou plasma anticoagulante con EDTA.
2. Recóllese a mostra segundo as técnicas estándar. A mostra de soro ou plasma pódese conservar refrixerada a 2-8 ℃ durante 7 días e crioconservarse por debaixo de -15 °C durante 6 meses.
3. Todas as mostras evitan os ciclos de conxelación e desconxelación.
PROCEDEMENTO DE ENSAIO
Lea o manual de funcionamento do instrumento e o prospecto antes de realizar a proba.
O resultado desta proba é só para referencia clínica e non debe servir como única base para o diagnóstico e tratamento clínico. A xestión clínica do paciente debe ser considerada de forma integral, combinada cos seus síntomas, historial médico, outras probas de laboratorio, resposta ao tratamento, epidemioloxía e outra información.
Este reactivo só se usa para probas de soro e plasma. Pode que non se obteñan resultados precisos cando se usa para outras mostras como saliva e ouriños, etc.
CARACTERÍSTICAS DE RENDEMENTO
| Linealidade | 0,005-5 | desviación relativa: do -15 % ao +15 %. |
| Coeficiente de correlación lineal: (r) ≥ 0,9900 | ||
| Precisión | A taxa de recuperación estará entre o 85 % e o 115 %. | |
| Repetibilidade | CV ≤ 15 % | |
REFERENCIAS
1. Hepatite postransfusional. En: Moore SB, ed. Enfermidades víricas transmitidas por transfusión. Alington, VA. Am. Assoc. Blood Banks, pp. 53-38.
2. Hansen JH e outros. Interferencia de HAMA con inmunoensaios baseados en anticorpos monoclonais murinos [J]. J of Clin Immunoassay, 1993, 16: 294-299.
3. Levinson SS. A natureza dos anticorpos heterófilos e o seu papel na interferencia nos inmunoensaios [J]. J of Clin Immunoassay, 1992, 15: 108-114.
4. Alter HJ., Purcell RH, Holland PV e outros (1978) Axente transmisible na hepatite non A nin B. Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus da hepatite C: o principal axente causante da hepatite vírica non A nin non B. Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Ensaio inmunosorbente ligado a encimas (ELISA): ensaio cualitativo de IgG. Immunochemistry 8:871-874.
VALORES ESPERADOS
Anticorpos do VHC <0,02
Recoméndase que cada laboratorio estableza o seu propio rango normal que represente a súa poboación de pacientes.
RESULTADOS DA PROBA E INTERPRETACIÓN
- Os datos anteriores son o resultado da proba do reactivo HCV-Ab, e suxírese que cada laboratorio estableza un rango de valores de detección HCV-Ab axeitados para a poboación desta rexión. Os resultados anteriores son só de referencia.
- Os resultados deste método só son aplicables aos rangos de referencia establecidos nel e non hai comparabilidade directa con outros métodos.
- Outros factores tamén poden causar erros nos resultados da detección, incluíndo razóns técnicas, erros operativos e outros factores da mostra.
ALMACENAMENTO E ESTABILIDADE
- O kit ten unha vida útil de 18 meses a partir da data de fabricación. Garde os kits non utilizados a 2-30 °C. NON CONXELE. Non o use despois da data de caducidade.
- Non abra a bolsa selada ata que estea listo para realizar unha proba e recoméndase que a proba dun só uso se use no ambiente requirido (temperatura 2-35 ℃, humidade 40-90 %) dentro de 60 minutos o máis rápido posible.
- O diluínte da mostra úsase inmediatamente despois de abrir.
AVISOS E PRECAUCIÓNS
O kit debe estar selado e protexido contra a humidade.
Todas as mostras positivas deberán validarse mediante outras metodoloxías.
.Todas as mostras deben tratarse como potenciais contaminantes.
.NON empregue reactivos caducados.
.NON intercambiar reactivos entre kits con diferente número de lote.
.NON reutilice as tarxetas de proba nin ningún accesorio desbotable.
.Un mal funcionamento, unha mostra excesiva ou pequena poden levar a desviacións nos resultados.
LIMITACIÓN
.Do mesmo xeito que con calquera ensaio que empregue anticorpos de rato, existe a posibilidade de interferencia de anticorpos humanos anti-rato (HAMA) na mostra. As mostras de pacientes que recibiron preparacións de anticorpos monoclonais para o diagnóstico ou a terapia poden conter HAMA. Estas mostras poden provocar resultados falsos positivos ou falsos negativos.
Clave dos símbolos empregados:
 | Dispositivo médico de diagnóstico in vitro |
 | Fabricante |
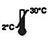 | Gardar a 2-30 ℃ |
 | Data de caducidade |
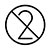 | Non reutilizar |
 | PRECAUCIÓN |
 | Consulte as instrucións de uso |