Test rapide de dépistage de l'hépatite C (HCV) de qualité supérieure, conforme aux normes de l'entreprise chinoise (bandelettes/cassettes).
Grâce à notre technologie de pointe, à notre esprit d'innovation, de coopération mutuelle, de bénéfices et de développement, nous allons bâtir ensemble un avenir prospère avec votre entreprise, en fournissant des bandelettes/cassettes de test rapide HCV de bonne qualité, conformes aux normes chinoises. En tant que jeune organisation en pleine croissance, nous ne sommes peut-être pas les meilleurs, mais nous nous efforçons d'être votre partenaire idéal.
Grâce à notre technologie de pointe, conjuguée à notre esprit d'innovation, de coopération mutuelle, de bénéfice et de développement, nous allons bâtir ensemble un avenir prospère avec votre entreprise estimée.Anti-HCV-Ns, Virus de l'hépatite C en ChineNous insistons toujours sur le principe de gestion suivant : « La qualité avant tout, la technologie comme fondement, l'honnêteté et l'innovation ». Nous avons ainsi pu développer en permanence de nouveaux produits et solutions de plus en plus performants afin de répondre aux différents besoins de nos clients.
Réservé à un usage diagnostique in vitro
Veuillez lire attentivement cette notice avant utilisation et suivre scrupuleusement les instructions. La fiabilité des résultats d'analyse ne peut être garantie en cas de non-respect des instructions de cette notice.
UTILISATION PRÉVUE
Le kit de diagnostic des anticorps anti-VHC (dosage immunochromatographique par fluorescence) est un test immunochromatographique par fluorescence permettant la détection quantitative des anticorps anti-VHC dans le sérum ou le plasma humain. Il constitue un outil diagnostique complémentaire important pour l'infection par le virus de l'hépatite C. Tout échantillon positif doit être confirmé par d'autres méthodes. Ce test est réservé à l'usage des professionnels de santé.
1. Laisser tous les réactifs et échantillons à température ambiante.
2. Ouvrez l'analyseur immunitaire portable (WIZ-A101), entrez le mot de passe du compte de connexion selon la méthode de fonctionnement de l'instrument et entrez dans l'interface de détection.
3. Scannez le code d'identification pour confirmer l'élément testé.
4. Sortez la carte de test du sachet en aluminium.
5. Insérez la carte de test dans la fente prévue à cet effet, scannez le code QR et déterminez l'élément testé.
6. Ajouter 20 μL d'échantillon de sérum ou de plasma au diluant d'échantillon et bien mélanger.
7. Ajouter 80 μL de solution échantillon dans le puits d'échantillon de la carte.
8. Cliquez sur le bouton « test standard ». Après 15 minutes, l'appareil détectera automatiquement la carte de test, il pourra lire les résultats sur l'écran de l'appareil et enregistrer/imprimer les résultats du test.
9.Se référer aux instructions de l'analyseur immunitaire portable (WIZ-A101).
RÉSUMÉ
Le virus de l'hépatite C (VHC) est un virus enveloppé à ARN monocaténaire de polarité positive (9,5 kb) appartenant à la famille des Flaviviridae. Six génotypes principaux et plusieurs sous-types de VHC ont été identifiés. Isolé en 1989, le VHC est aujourd'hui reconnu comme la principale cause d'hépatite non-A non-B post-transfusionnelle. La maladie se caractérise par une forme aiguë et une forme chronique. Plus de 50 % des personnes infectées développent une hépatite chronique sévère, potentiellement mortelle, avec cirrhose et carcinome hépatocellulaire. Depuis l'introduction, en 1990, du dépistage anti-VHC dans les dons de sang, l'incidence de cette infection chez les receveurs de transfusions a considérablement diminué. Des études cliniques montrent qu'un nombre significatif de personnes infectées par le VHC développent des anticorps dirigés contre la protéine non structurale NS5 du virus. Pour cela, les tests incluent des antigènes de la région NS5 du génome viral en plus de NS3 (c200), NS4 (c200) et du Core (c22).
PRINCIPE DE LA PROCÉDURE
La membrane du dispositif de test est recouverte d'antigène VHC sur la zone de test et d'anticorps IgG anti-lapin de chèvre sur la zone de contrôle. Les tampons de marquage sont préalablement recouverts d'antigène VHC et d'IgG de lapin marqués par fluorescence. Lors du test d'un échantillon positif, les anticorps anti-VHC présents dans l'échantillon se lient à l'antigène VHC marqué par fluorescence, formant un complexe immun. Sous l'action de l'immunochromatographie, ce complexe migre vers le papier absorbant. Lorsqu'il atteint la zone de test, il se lie à l'antigène VHC fixé sur la membrane, formant un nouveau complexe. Le taux d'anticorps anti-VHC est corrélé positivement au signal de fluorescence, et la concentration d'anticorps anti-VHC dans l'échantillon peut être déterminée par dosage immuno-enzymatique par fluorescence.
RÉACTIFS ET MATÉRIAUX FOURNIS
Composants du paquet 25T:
Carte de test emballée individuellement sous film plastique avec un dessiccant
.Échantillons de diluants
Notice d'emballage
MATÉRIEL REQUIS MAIS NON FOURNI
Conteneur de prélèvement d'échantillons, minuterie
COLLECTE ET STOCKAGE DES ÉCHANTILLONS
1. Les échantillons testés peuvent être du sérum, du plasma anticoagulant à l'héparine ou du plasma anticoagulant à l'EDTA.
2. Prélever l'échantillon selon les techniques standard. L'échantillon de sérum ou de plasma peut être conservé au réfrigérateur entre 2 et 8 °C pendant 7 jours et cryoconservé à une température inférieure à -15 °C pendant 6 mois.
3. Tous les échantillons doivent être protégés des cycles de congélation-décongélation.
PROCÉDURE D'ANALYSE
Veuillez lire le manuel d'utilisation de l'instrument et la notice d'emballage avant de procéder aux tests.
Ce résultat de test est uniquement destiné à servir de référence clinique et ne doit pas constituer la seule base du diagnostic et du traitement cliniques. La prise en charge clinique du patient doit reposer sur une analyse globale prenant en compte ses symptômes, ses antécédents médicaux, les autres examens de laboratoire, la réponse au traitement, l'épidémiologie et d'autres informations.
Ce réactif est exclusivement destiné aux analyses de sérum et de plasma. Son utilisation sur d'autres types d'échantillons, tels que la salive et l'urine, peut ne pas donner de résultats précis.
CARACTÉRISTIQUES DE PERFORMANCE
| Linéarité | 0,005-5 | Écart relatif : -15 % à +15 %. |
| Coefficient de corrélation linéaire (r) ≥ 0,9900 | ||
| Précision | Le taux de récupération doit se situer entre 85 % et 115 %. | |
| Répétabilité | CV≤15% | |
RÉFÉRENCES
1. Hépatite post-transfusionnelle. Dans : Moore SB, éd. Maladies virales transmises par transfusion. Alington, VA. Am. Assoc. Blood Banks, pp. 53-38.
2.Hansen JH,et al.Interférence HAMA avec les immunoessais à base d'anticorps monoclonaux murins[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS.La nature des anticorps hétérophiles et leur rôle dans l'interférence des immunoessais [J].J of Clin Immunoassay,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, et al. (1978) Agent transmissible dans l'hépatite non-A, non-B. Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus de l'hépatite C : le principal agent causal de l'hépatite virale non-A, non-B. Br Med Bull 46 : 423-441.
6.Engvall E, Perlmann P. (1971) Dosage immuno-enzymatique (ELISA) : dosage qualitatif des IgG. Immunochemistry 8:871-874.
VALEURS ATTENDUES
HCV-Ab<0,02
Il est recommandé que chaque laboratoire établisse ses propres valeurs de référence, représentatives de sa population de patients.
RÉSULTATS ET INTERPRÉTATION DES TESTS
- Les données ci-dessus proviennent du test de dépistage des anticorps anti-VHC. Il est recommandé à chaque laboratoire d'établir une plage de valeurs de détection des anticorps anti-VHC adaptée à la population de cette région. Ces résultats sont fournis à titre indicatif uniquement.
- Les résultats de cette méthode ne sont applicables qu'aux intervalles de référence établis dans cette méthode, et il n'y a pas de comparaison directe possible avec d'autres méthodes.
- D'autres facteurs peuvent également entraîner des erreurs dans les résultats de détection, notamment des raisons techniques, des erreurs opérationnelles et d'autres facteurs liés à l'échantillon.
STOCKAGE ET STABILITÉ
- Ce kit se conserve 18 mois à compter de sa date de fabrication. Conserver les kits non utilisés entre 2 et 30 °C. NE PAS CONGELER. Ne pas utiliser après la date de péremption.
- N’ouvrez pas le sachet scellé avant d’être prêt à effectuer un test, et il est suggéré d’utiliser le test à usage unique dans l’environnement requis (température 2-35℃, humidité 40-90%) dans les 60 minutes le plus rapidement possible.
- Le diluant de l'échantillon est utilisé immédiatement après ouverture.
AVERTISSEMENTS ET PRÉCAUTIONS
Le kit doit être scellé et protégé de l'humidité.
Tous les échantillons positifs devront être validés par d'autres méthodes.
.Tous les échantillons doivent être considérés comme des polluants potentiels.
.N’utilisez PAS de réactif périmé.
.NE PAS intervertir les réactifs entre les kits ayant des numéros de lot différents.
.NE PAS réutiliser les cartes de test ni les accessoires jetables.
.Une mauvaise manipulation, un échantillon excessif ou insuffisant peuvent entraîner des écarts dans les résultats.
LIMITATION
.Comme pour tout test utilisant des anticorps de souris, une interférence par des anticorps anti-souris humains (HAMA) présents dans l'échantillon est possible. Les échantillons provenant de patients ayant reçu des préparations d'anticorps monoclonaux à visée diagnostique ou thérapeutique peuvent contenir des HAMA. Ces échantillons peuvent entraîner des résultats faussement positifs ou faussement négatifs.
Légende des symboles utilisés :
 | Dispositif médical de diagnostic in vitro |
 | Fabricant |
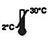 | Conserver entre 2 et 30 °C |
 | Date d'expiration |
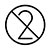 | Ne pas réutiliser |
 | PRUDENCE |
 | Consulter le mode d'emploi |