Diagnostinen pakkaus hepatiitti C -viruksen vasta-aineille (fluoresenssi-immunokromatografinen määritys)
Vain in vitro -diagnostiikkaan
Lue tämä pakkausseloste huolellisesti ennen käyttöä ja noudata ohjeita tarkasti. Määritystulosten luotettavuutta ei voida taata, jos pakkausselosteen ohjeista poiketaan.
KÄYTTÖTARKOITUS
Diagnostinen pakkaus hepatiitti C -viruksen vasta-aineille (fluoresenssi-immunokromatografinen määritys) on fluoresenssi-immunokromatografinen määritys HCV-vasta-aineiden kvantitatiiviseen havaitsemiseen ihmisen seerumista tai plasmasta, mikä on tärkeä apudiagnostinen arvo hepatiitti C -infektiossa. Kaikki positiiviset näytteet on vahvistettava muilla menetelmillä. Tämä testi on tarkoitettu vain terveydenhuollon ammattilaisten käyttöön.
1. Anna kaikkien reagenssien ja näytteiden lämmetä huoneenlämpöön.
2. Avaa kannettava immuunianalysaattori (WIZ-A101), anna laitteen toimintatavan mukainen tilin salasana ja siirry tunnistuskäyttöliittymään.
3. Skannaa tunnistuskoodi vahvistaaksesi testattavan kohteen.
4. Ota testikortti foliopussista.
5. Aseta testikortti korttipaikkaan, skannaa QR-koodi ja määritä testikohde.
6. Lisää 20 μl seerumi- tai plasmanäytettä näytteenlaimennusliuokseen ja sekoita hyvin.
7. Lisää 80 μL näyteliuosta kortin näytekaivoon.
8. Napsauta ”vakiotesti”-painiketta. 15 minuutin kuluttua laite tunnistaa testikortin automaattisesti, lukee tulokset laitteen näytöltä ja tallentaa/tulostaa testitulokset.
9. Katso kannettavan immuunijärjestelmän analysaattorin (WIZ-A101) ohjeet.
YHTEENVETO
Hepatiitti C -virus (HCV) on vaippamainen, yksijuosteinen positiivisen sense-RNA:n (9,5 kb) sisältävä virus, joka kuuluu Flaviviridae-heimoon. HCV:stä on tunnistettu kuusi päägenotyyppiä ja alatyyppien sarjaa. Vuonna 1989 eristetty HCV tunnustetaan nyt verensiirtoon liittyvän non-A- ja non-B-hepatiitin pääasialliseksi aiheuttajaksi. Taudille on ominaista akuutti ja krooninen muoto. Yli 50 %:lle tartunnan saaneista henkilöistä kehittyy vakava, hengenvaarallinen krooninen hepatiitti, johon liittyy maksakirroosi ja maksasolukarsinooma. Verenluovutusten HCV-seulonnan käyttöönoton jälkeen vuonna 1990 tämän infektion ilmaantuvuus verensiirron saaneilla on vähentynyt merkittävästi. Kliiniset tutkimukset osoittavat, että merkittävä osa HCV-tartunnan saaneista henkilöistä kehittää vasta-aineita viruksen NS5-ei-rakenneproteiinille. Tätä varten testeihin sisältyy virusgenomin NS5-alueen antigeenejä NS3:n (c200), NS4:n (c200) ja Coren (c22) lisäksi.
MENETTELYN PERIAATE
Testilaitteen kalvo on päällystetty HCV-antigeenilla testialueella ja vuohen anti-kaniini-IgG-vasta-aineella kontrollialueella. Etikettilevyt on päällystetty fluoresenssimerkityllä HCV-antigeenilla ja kaniini-IgG:llä etukäteen. Positiivista näytettä testattaessa näytteessä oleva HCV-vasta-aine yhdistyy fluoresenssimerkityn HCV-antigeenin kanssa ja muodostaa immuuniseoksen. Immunokromatografian vaikutuksesta kompleksi virtaa imukykyisen paperin suuntaan. Kun kompleksi kulkee testialueen läpi, se yhdistyy HCV-antigeenia päällystävän antigeenin kanssa ja muodostaa uuden kompleksin. HCV-vasta-ainetaso korreloi positiivisesti fluoresenssisignaalin kanssa, ja HCV-vasta-aineen pitoisuus näytteessä voidaan havaita fluoresenssi-immunomäärityksellä.
TOIMITETUT REAGENSSIT JA MATERIAALIT
25T-pakkauksen komponentit:
Testikortti erikseen pakattuna folioon kuivausaineen kanssa
Näytteen laimennusaineet
Pakkausseloste
VAADITTAVAT, MUTTA EI TOIMITETA TOIMITUKSEEN
Näytteenkeräysastia, ajastin
NÄYTTEEN KERÄYS JA SÄILYTYS
1. Testattavat näytteet voivat olla seerumia, hepariiniantikoagulanttiplasmaa tai EDTA-antikoagulanttiplasmaa.
2. Kerää näyte vakiomenetelmien mukaisesti. Seerumi- tai plasmanäytettä voidaan säilyttää jääkaapissa 2–8 ℃:ssa 7 päivää ja kryosäilytyksenä alle -15 °C:ssa 6 kuukautta.
3. Kaikki näytteet välttävät pakastus-sulatusjaksoja.
MÄÄRITYSMENETTELY
Lue laitteen käyttöohje ja pakkausseloste ennen testausta.
Tämä testitulos on tarkoitettu vain kliiniseen viitteeseen, eikä sitä tule käyttää ainoana perustana kliiniselle diagnoosille ja hoidolle. Potilaan kliinisen hoidon tulee olla kokonaisvaltaista ja ottaa huomioon oireet, sairaushistoria, muut laboratoriotutkimukset, hoitovaste, epidemiologia ja muut tiedot.
Tätä reagenssia käytetään vain seerumin ja plasman testeihin. Se ei välttämättä anna tarkkoja tuloksia, jos sitä käytetään muiden näytteiden, kuten syljen ja virtsan, yms. testaukseen.
SUORITUSKYKYOMINAISUUDET
| Lineaarisuus | 0,005–5 | suhteellinen poikkeama: -15 % - +15 %. |
| Lineaarinen korrelaatiokerroin: (r) ≥0,9900 | ||
| Tarkkuus | Palautumisasteen on oltava 85–115 %. | |
| Toistettavuus | Variaatiokerroin ≤ 15 % | |
VIITTEET
1. Verensiirron jälkeinen hepatiitti. Teoksessa: Moore SB, toim. Transfusion-Transmitted Viral Diseases. Alington, VA. Am. Assoc. Blood Banks, s. 53-38.
2. Hansen JH ym. HAMA-interferenssi hiiren monoklonaalisiin vasta-aineisiin perustuvissa immunomäärityksissä [J]. J of Clin Immunoassay, 1993, 16:294-299.
3. Levinson SS. Heterofiilisten vasta-aineiden luonne ja rooli immunomäärityksen häirinnässä [J]. J of Clin Immunoassay, 1992, 15:108-114.
4.Alter HJ., Purcell RH, Holland PV ym. (1978) Tarttuva taudinaiheuttaja ei-A- ja ei-B-hepatiitissa. Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Hepatiitti C -virus: virusperäisen non-A- ja non-B-hepatiitin pääasiallinen aiheuttaja. Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Entsyymi-immunologinen määritys (ELISA): IgG:n kvalitatiivinen määritys. Immunochemistry 8:871-874.
ODOTETUT ARVOT
HCV-Ab < 0,02
On suositeltavaa, että jokainen laboratorio määrittää oman normaalialueensa, joka edustaa sen potilaspopulaatiota.
TESTITULOKSET JA TULKINTA
- Yllä olevat tiedot ovat HCV-Ab-reagenssitestin tuloksia, ja jokaisen laboratorion tulisi määrittää alueen väestölle sopiva HCV-Ab-detektioarvojen vaihteluväli. Yllä olevat tulokset ovat vain viitteellisiä.
- Tämän menetelmän tulokset soveltuvat vain tässä menetelmässä määritettyihin viitearvoihin, eikä niitä voida suoraan verrata muihin menetelmiin.
- Myös muut tekijät voivat aiheuttaa virheitä havaitsemistuloksissa, mukaan lukien tekniset syyt, toiminnalliset virheet ja muut otostekijät.
SÄILYTYS JA STABIILISUUS
- Pakkauksen säilyvyysaika on 18 kuukautta valmistuspäivästä. Säilytä käyttämättömät pakkaukset 2–30 °C:ssa. EI SAA JÄÄDYTTÄÄ. Älä käytä viimeisen käyttöpäivämäärän jälkeen.
- Älä avaa sinetöityä pussia ennen kuin olet valmis suorittamaan testin. Kertakäyttötestiä suositellaan käytettäväksi vaaditussa ympäristössä (lämpötila 2–35 ℃, kosteus 40–90 %) 60 minuutin kuluessa mahdollisimman pian.
- Näytteen laimennusainetta käytetään heti avaamisen jälkeen.
VAROITUKSET JA VAROTOIMENPITEET
Pakkaus tulee tiivistää ja suojata kosteudelta.
Kaikki positiiviset näytteet on validoitava muilla menetelmillä.
.Kaikkia näytteitä on käsiteltävä mahdollisina saasteina.
.ÄLÄ käytä vanhentunutta reagenssia.
.ÄLÄ vaihda reagensseja eri eränumeroilla varustettujen pakkausten välillä.
.ÄLÄ käytä testikortteja ja kertakäyttöisiä lisävarusteita uudelleen.
.Väärä toimintatapa, liiallinen tai liian pieni näytemäärä voivat johtaa tulospoikkeamiin.
LJÄLJITELMÄ
.Kuten kaikissa hiiren vasta-aineita käyttävissä määrityksissä, näytteessä olevat ihmisen hiiren vasta-aineet (HAMA) voivat häiritä testitulosta. Näytteet potilailta, jotka ovat saaneet monoklonaalisia vasta-aineita diagnoosia tai hoitoa varten, voivat sisältää HAMA:a. Tällaiset näytteet voivat aiheuttaa vääriä positiivisia tai vääriä negatiivisia tuloksia.
Käytettyjen symbolien selitteet:
 | In vitro -diagnostinen lääkinnällinen laite |
 | Valmistaja |
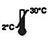 | Säilytä 2–30 ℃:ssa |
 | Voimassaolopäivä |
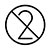 | Älä käytä uudelleen |
 | VAROITUS |
 | Katso käyttöohjeet |