Sydämen troponiini I:n diagnostiikkapakkaus (fluoresenssi-immunokromatografinen määritys)
Sydämen troponiini I:n diagnostiikkapakkaus(fluoresenssi-immunokromatografinen määritys)
Vain in vitro -diagnostiikkaan
Lue tämä pakkausseloste huolellisesti ennen käyttöä ja noudata ohjeita tarkasti. Määritystulosten luotettavuutta ei voida taata, jos pakkausselosteen ohjeista poiketaan.
KÄYTTÖTARKOITUS
Sydämen troponiini I:n diagnostinen pakkaus (fluoresenssi-immunokromatografinen määritys) on fluoresenssi-immunokromatografinen määritys sydämen troponiini I:n (cTnI) kvantitatiiviseen havaitsemiseen ihmisen seerumista tai plasmasta. Sitä käytetään AMI:n (akuutti sydäninfarkti) lisädiagnostiikkaan. Kaikki positiiviset näytteet on vahvistettava muilla menetelmillä. Tämä testi on tarkoitettu vain terveydenhuollon ammattilaisten käyttöön.
YHTEENVETO
cTnI-pitoisuudet nousivat useita tunteja sydäninfarktin jälkeen, saavuttivat huippunsa 12–16 tunnissa ja pysyivät koholla 4–9 päivää sydäninfarktin jälkeen. Kolmannen sydäninfarktin maailmanlaajuinen määritelmä vuonna 2012: Suositeltava biomarkkeri, cTn (I tai T), on erittäin spesifinen sydänlihaskudokseen ja erittäin kliinisesti herkkä. cTn-pitoisuuden muutokset ovat olennaisia sydäninfarktin diagnosoinnissa.
MENETTELYN PERIAATE
Testilaitteen kalvo on päällystetty anti-cTnI-vasta-aineella testialueella ja vuohen anti-kaniini-IgG-vasta-aineella kontrollialueella. Etikettityynyt on päällystetty fluoresenssimerkityllä anti-cTnI-vasta-aineella ja kaniini-IgG:llä etukäteen. Positiivista näytettä testattaessa näytteessä oleva cTnI-antigeeni yhdistyy fluoresenssimerkityn anti-cTnI-vasta-aineen kanssa ja muodostaa immuuniseoksen. Immunokromatografian vaikutuksesta kompleksi virtaa imukykyisen paperin suuntaan. Kun kompleksi kulkee testialueen läpi, se yhdistyy anti-cTnI-päällystevasta-aineeseen ja muodostaa uuden kompleksin. cTnI-taso korreloi positiivisesti fluoresenssisignaalin kanssa, ja cTnI-pitoisuus näytteessä voidaan havaita fluoresenssi-immunomäärityksellä.
TOIMITETUT REAGENSSIT JA MATERIAALIT
25T-pakkauksen komponentit:
Testikortti erikseen foliossa pussattu kuivausaineen kanssa 25T
Näytteen laimennusaineet 25T
Pakkausseloste 1
VAADITTAVAT, MUTTA EI TOIMITETA TOIMITUKSEEN
Näytteenkeräysastia, ajastin
NÄYTTEEN KERÄYS JA SÄILYTYS
1. Testattavat näytteet voivat olla seerumia, hepariiniantikoagulanttiplasmaa tai EDTA-antikoagulanttiplasmaa.
2. Kerää näyte vakiomenetelmien mukaisesti. Seerumi- tai plasmanäytettä voidaan säilyttää jääkaapissa 2–8 ℃:ssa 7 päivää ja kryosäilytyksessä alle -15 °C:ssa 6 kuukautta.
3. Kaikki näytteet välttävät pakastus-sulatusjaksoja.
MÄÄRITYSMENETTELY
Lue laitteen käyttöohje ja pakkausseloste ennen testausta.
1. Anna kaikkien reagenssien ja näytteiden lämmetä huoneenlämpöön.
2. Avaa kannettava immuunianalysaattori (WIZ-A101), anna laitteen toimintatavan mukainen tilin salasana ja siirry tunnistuskäyttöliittymään.
3. Skannaa tunnistuskoodi vahvistaaksesi testattavan kohteen.
4. Ota testikortti foliopussista.
5. Aseta testikortti korttipaikkaan, skannaa QR-koodi ja määritä testikohde.
6. Lisää 40 μl seerumi- tai plasmanäytettä näytteenlaimennusliuokseen ja sekoita hyvin.
7. Lisää 80 μL näyteliuosta kortin näytekaivoon.
8. Napsauta ”vakiotesti”-painiketta. 15 minuutin kuluttua laite tunnistaa testikortin automaattisesti, lukee tulokset laitteen näytöltä ja tallentaa/tulostaa testitulokset.
9. Katso kannettavan immuunijärjestelmän analysaattorin (WIZ-A101) ohjeet.
ODOTETUT ARVOT
cTnI <0,3 ng/ml
On suositeltavaa, että jokainen laboratorio määrittää oman normaalialueensa, joka edustaa sen potilaspopulaatiota.
TESTITULOKSET JA TULKINTA
Yllä olevat tiedot ovat cTnI-reagenssitestin tuloksia, ja jokaisen laboratorion tulisi määrittää alueen väestölle sopiva cTnI-detektioarvojen vaihteluväli. Yllä olevat tulokset ovat vain viitteellisiä.
Tämän menetelmän tulokset soveltuvat vain tässä menetelmässä määritettyihin viitearvoalueisiin, eikä niitä voida suoraan verrata muihin menetelmiin.
Myös muut tekijät, kuten tekniset syyt, toiminnalliset virheet ja muut otantatekijät, voivat aiheuttaa virheitä havaitsemistuloksissa.
SÄILYTYS JA STABIILISUUS
1. Pakkauksen säilyvyysaika on 18 kuukautta valmistuspäivästä. Säilytä käyttämättömät pakkaukset 2–30 °C:ssa. EI SAA JÄÄDYTTÄÄ. Älä käytä viimeisen käyttöpäivämäärän jälkeen.
2. Älä avaa sinetöityä pussia ennen kuin olet valmis suorittamaan testin. Kertakäyttötestiä suositellaan käytettäväksi vaaditussa ympäristössä (lämpötila 2–35 ℃, kosteus 40–90 %) 60 minuutin kuluessa mahdollisimman nopeasti.
3. Näytteen laimenninta käytetään heti avaamisen jälkeen.
VAROITUKSET JA VAROTOIMENPITEET
Pakkaus tulee tiivistää ja suojata kosteudelta.
Kaikki positiiviset näytteet on validoitava muilla menetelmillä.
Kaikkia näytteitä on käsiteltävä mahdollisina saasteina.
ÄLÄ käytä vanhentunutta reagenssia.
ÄLÄ vaihda reagensseja eri eränumeroilla varustettujen pakkausten välillä.
ÄLÄ käytä testikortteja ja kertakäyttöisiä lisävarusteita uudelleen.
Väärinkäyttö, liiallinen tai liian pieni näytemäärä voivat johtaa tulospoikkeamiin.
LJÄLJITELMÄ
Kuten kaikissa hiiren vasta-aineita käyttävissä määrityksissä, näytteessä olevat ihmisen hiiren vasta-aineet (HAMA) voivat häiritä testitulosta. Näytteet potilailta, jotka ovat saaneet monoklonaalisia vasta-aineita diagnoosia tai hoitoa varten, voivat sisältää HAMA:a. Tällaiset näytteet voivat aiheuttaa vääriä positiivisia tai vääriä negatiivisia tuloksia.
Tämä testitulos on tarkoitettu vain kliiniseen viitteeseen, eikä sitä tule käyttää ainoana perustana kliiniselle diagnoosille ja hoidolle. Potilaan kliinisen hoidon tulee olla kokonaisvaltaista ja ottaa huomioon oireet, sairaushistoria, muut laboratoriotutkimukset, hoitovaste, epidemiologia ja muut tiedot.
Tätä reagenssia käytetään vain seerumin ja plasman testeihin. Se ei välttämättä anna tarkkoja tuloksia, jos sitä käytetään muiden näytteiden, kuten syljen ja virtsan, yms. testaukseen.
SUORITUSKYKYOMINAISUUDET
| Lineaarisuus | 0,1 ng/ml - 40 ng/ml | suhteellinen poikkeama: -15 % - +15 %. |
| Lineaarinen korrelaatiokerroin: (r) ≥0,9900 | ||
| Tarkkuus | Palautumisasteen on oltava 85–115 %. | |
| Toistettavuus | Variaatiokerroin ≤ 15 % | |
| Spesifisyys(Mikään testatun häiritsevän aineen aineista ei häirinnyt määritystä) | Häiritsevä | Häiritsevä pitoisuus |
| sTnI | 1000 μg/l | |
| cTnT | 1000 μg/l | |
| Eläinperäinen sivutuote | 1000 μg/l | |
| CK-MB | 1000 μg/l | |
| cTnC | 1000 μg/l | |
| sTnT | 1000 μg/l | |
| MYO | 1000 μg/l | |
RREFERENSSIT
1. Hansen JH ym. HAMA-interferenssi hiiren monoklonaalisiin vasta-aineisiin perustuvissa immunomäärityksissä [J]. J of Clin Immunoassay, 1993, 16:294-299.
2. Levinson SS. Heterofiilisten vasta-aineiden luonne ja rooli immunomäärityksen häirinnässä [J]. J of Clin Immunoassay, 1992, 15:108-114.
Käytettyjen symbolien selitteet:
 | In vitro -diagnostinen lääkinnällinen laite |
 | Valmistaja |
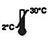 | Säilytä 2–30 ℃:ssa |
 | Voimassaolopäivä |
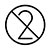 | Älä käytä uudelleen |
 | VAROITUS |
 | Katso käyttöohjeet |
Xiamen Wiz Biotech CO., LTD
Osoite: 3.–4. kerros, rakennus nro 16, biolääketieteellinen työpaja, Wengjiao West Road 2030, Haicangin alue, 361026, Xiamen, Kiina
Puh: +86-592-6808278
Faksi: +86-592-6808279