Diagnostinen pakkaus Helicobacter Pylori -bakteerin antigeenille (fluoresenssi-immunokromatografinen määritys)
Diagnostinen pakkaus Helicobacter Pylori -bakteerin antigeenille(Fluoresenssi-immunokromatografinen määritys)
Vain in vitro -diagnostiikkaan
Lue tämä pakkausseloste huolellisesti ennen käyttöä ja noudata ohjeita tarkasti. Määritystulosten luotettavuutta ei voida taata, jos pakkausselosteen ohjeista poiketaan.
KÄYTTÖTARKOITUS
Helicobacter Pylori -bakteerin antigeenin diagnostiikkasarja (fluoresenssi-immunokromatografinen määritys) soveltuu ihmisen ulosteen HP-antigeenin kvantitatiiviseen havaitsemiseen fluoresenssi-immunokromatografisella määrityksellä, jolla on tärkeä lisädiagnostinen arvo mahainfektioiden varalta. Kaikki positiiviset näytteet on vahvistettava muilla menetelmillä. Tämä testi on tarkoitettu vain terveydenhuollon ammattilaisten käyttöön.
YHTEENVETO
Mahalaukun helicobacter pylori -infektio liittyy läheisesti krooniseen gastriittiin, mahahaavaan, mahalaukun adenokarsinoomaan, mahalaukun limakalvoon liittyvään lymfoomaan. H. pylori -infektion määrä on noin 90 % gastriitti-, mahahaava-, pohjukaissuolihaava- ja mahasyöpäpotilailla. Maailman terveysjärjestö on tunnistanut h. pylorin ensisijaiseksi syöpää aiheuttavaksi tekijäksi ja selvästi mahalaukun syövän riskitekijäksi. H. pylorin havaitseminen on erittäin arvokasta h. pylori -infektion diagnosoinnissa. Testi perustuu fluoresenssi-immunokromatografiseen analyysitekniikkaan, joka voi antaa tuloksen 15 minuutissa.
MENETTELYN PERIAATE
Testiliuskassa on anti-HP-pinnoitevasta-ainetta testialueella, joka on etukäteen kiinnitetty kalvokromatografiaan. Etikettialusta on etukäteen päällystetty fluoresenssimerkityllä anti-HP-vasta-aineella. Positiivista näytettä testattaessa näytteessä oleva HP voidaan sekoittaa fluoresenssimerkityn anti-HP-vasta-aineen kanssa ja muodostaa immuuniseos. Kun seos kulkeutuu testiliuskaa pitkin, HP-konjugaattikompleksi kiinnittyy kalvon anti-HP-pinnoitevasta-aineeseen ja muodostaa kompleksin. Fluoresenssin intensiteetti korreloi positiivisesti HP-pitoisuuden kanssa. Näytteessä oleva HP voidaan havaita fluoresenssi-immunomäärityksellä.
TOIMITETUT REAGENSSIT JA MATERIAALIT
25T-pakkauksen komponentit:
Testikortti erikseen foliossa pussattu kuivausaineen kanssa 25T
Näytteen laimennusaineet 25T
Pakkausseloste 1
VAADITTAVAT, MUTTA EI TOIMITETA TOIMITUKSEEN
Näytteenkeräysastia, ajastin
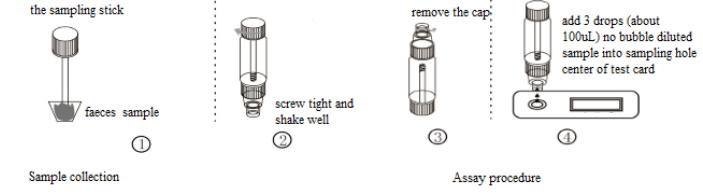
NÄYTTEEN KERÄYS JA SÄILYTYS
1. Käytä kertakäyttöistä puhdasta astiaa tuoreen ulostenäytteen keräämiseen ja testaa se välittömästi. Jos sitä ei voida testata välittömästi, säilytä 2–8 °C:ssa 3 päivää tai alle -15 °C:ssa 6 kuukautta.
2. Ota näytetikku ulos ja aseta se ulostenäytteeseen. Toista toimenpide kolme kertaa. Ota joka kerta ulostenäytteen eri osat. Laita näytetikku takaisin paikoilleen, kierrä tiukasti kiinni ja ravista hyvin. Tai ota näytetikulla noin 50 mg ulostenäytettä ja aseta se laimennettua näytettä sisältävään ulostenäyteputkeen. Kierrä tiukasti kiinni.
3. Ota ripulipotilaan ulostenäyte kertakäyttöpipetillä. Lisää sitten 3 tippaa (noin 100 µl) ulostenäytteenottoputkeen ja ravista hyvin.
Huomautuksia:
1. Vältä pakastus-sulatusjaksoja.
2. Sulata näytteet huoneenlämpöisiksi ennen käyttöä.
MÄÄRITYSMENETTELY
Lue laitteen käyttöohje ja pakkausseloste ennen testausta.
1. Anna kaikkien reagenssien ja näytteiden lämmetä huoneenlämpöön.
2. Avaa kannettava immuunianalysaattori (WIZ-A101), anna laitteen toimintatavan mukainen tilin salasana ja siirry tunnistuskäyttöliittymään.
3. Skannaa tunnistuskoodi vahvistaaksesi testattavan kohteen.
4. Ota testikortti foliopussista.
5. Aseta testikortti korttipaikkaan, skannaa QR-koodi ja määritä testikohde.
6. Poista näyteputken korkki ja hävitä kaksi ensimmäistä tippaa laimennettua näytettä. Lisää sitten 3 tippaa (noin 100 μl) kuplatonta laimennettua näytettä pystysuunnassa ja hitaasti kortin näytekaivoon mukana toimitetulla dispetillä.
7. Napsauta ”vakiotesti”-painiketta. 15 minuutin kuluttua laite tunnistaa testikortin automaattisesti, lukee tulokset laitteen näytöltä ja tallentaa/tulostaa testitulokset.
8. Katso kannettavan immuunijärjestelmän analysaattorin (WIZ-A101) ohjeet.
ODOTETUT ARVOT
HP-Ag<10
On suositeltavaa, että jokainen laboratorio määrittää oman normaalialueensa, joka edustaa sen potilaspopulaatiota.
TESTITULOKSET JA TULKINTA
1. Näytteen HP-Ag-pitoisuus on yli 10, mikä sulkee pois fysiologisen tilan muutoksen. Tulokset ovat todellakin poikkeavia ja ne tulisi diagnosoida kliinisten oireiden perusteella.
2. Tämän menetelmän tulokset soveltuvat vain tässä menetelmässä määritettyihin viitealueisiin, eikä niitä voida suoraan verrata muihin menetelmiin.
3. Myös muut tekijät voivat aiheuttaa virheitä havaitsemistuloksissa, mukaan lukien tekniset syyt, toiminnalliset virheet ja muut otostekijät.
SÄILYTYS JA STABIILISUUS
1. Pakkauksen säilyvyysaika on 18 kuukautta valmistuspäivästä. Säilytä käyttämättömät pakkaukset 2–30 °C:ssa. EI SAA JÄÄDYTTÄÄ. Älä käytä viimeisen käyttöpäivämäärän jälkeen.
2. Älä avaa sinetöityä pussia ennen kuin olet valmis suorittamaan testin. Kertakäyttötestiä suositellaan käytettäväksi vaaditussa ympäristössä (lämpötila 2–35 ℃, kosteus 40–90 %) 60 minuutin kuluessa mahdollisimman nopeasti.
3. Näytteen laimenninta käytetään heti avaamisen jälkeen.
VAROITUKSET JA VAROTOIMENPITEET
Pakkaus tulee tiivistää ja suojata kosteudelta.
Kaikki positiiviset näytteet on validoitava muilla menetelmillä.
Kaikkia näytteitä on käsiteltävä mahdollisina saasteina.
ÄLÄ käytä vanhentunutta reagenssia.
ÄLÄ vaihda reagensseja eri eränumeroilla varustettujen pakkausten välillä.
ÄLÄ käytä testikortteja ja kertakäyttöisiä lisävarusteita uudelleen.
Väärinkäyttö, liiallinen tai liian pieni näytemäärä voivat johtaa tulospoikkeamiin.
LJÄLJITELMÄ
Kuten kaikissa hiiren vasta-aineita käyttävissä määrityksissä, näytteessä olevat ihmisen hiiren vasta-aineet (HAMA) voivat häiritä testitulosta. Näytteet potilailta, jotka ovat saaneet monoklonaalisia vasta-aineita diagnoosia tai hoitoa varten, voivat sisältää HAMA:a. Tällaiset näytteet voivat aiheuttaa vääriä positiivisia tai vääriä negatiivisia tuloksia.
Tämä testitulos on tarkoitettu vain kliiniseen viitteeseen, eikä sitä tule käyttää ainoana perustana kliiniselle diagnoosille ja hoidolle. Potilaan kliinisen hoidon tulee olla kokonaisvaltaista ja ottaa huomioon oireet, sairaushistoria, muut laboratoriotutkimukset, hoitovaste, epidemiologia ja muut tiedot.
Tätä reagenssia käytetään vain ulostetesteihin. Se ei välttämättä anna tarkkoja tuloksia, jos sitä käytetään muiden näytteiden, kuten syljen ja virtsan, testaamiseen.
SUORITUSKYKYOMINAISUUDET
| Lineaarisuus | 10–1000 | suhteellinen poikkeama: -15 % - +15 %. |
| Lineaarinen korrelaatiokerroin: (r) ≥0,9900 | ||
| Tarkkuus | Palautumisasteen on oltava 85–115 %. | |
| Toistettavuus | Variaatiokerroin ≤ 15 % | |
RREFERENSSIT
1. Shao, JL ja F. Wu. Helicobacter pylorin havaitsemismenetelmien viimeaikaiset edistysaskeleet [J]. Journal of Gastroenterology and Hepatology, 2012, 21 (8): 691-694
2. Hansen JH ym. HAMA-interferenssi hiiren monoklonaalisiin vasta-aineisiin perustuvissa immunomäärityksissä [J]. J of Clin Immunoassay, 1993, 16:294-299.
3. Levinson SS. Heterofiilisten vasta-aineiden luonne ja rooli immunomäärityksen häirinnässä [J]. J of Clin Immunoassay, 1992, 15:108-114.
Käytettyjen symbolien selitteet:
 | In vitro -diagnostinen lääkinnällinen laite |
 | Valmistaja |
 | Säilytä 2–30 ℃:ssa |
 | Voimassaolopäivä |
 | Älä käytä uudelleen |
 | VAROITUS |
 | Katso käyttöohjeet |
Xiamen Wiz Biotech CO., LTD
Osoite: 3.–4. kerros, rakennus nro 16, biolääketieteellinen työpaja, Wengjiao West Road 2030, Haicangin alue, 361026, Xiamen, Kiina
Puh: +86-592-6808278
Faksi: +86-592-6808279