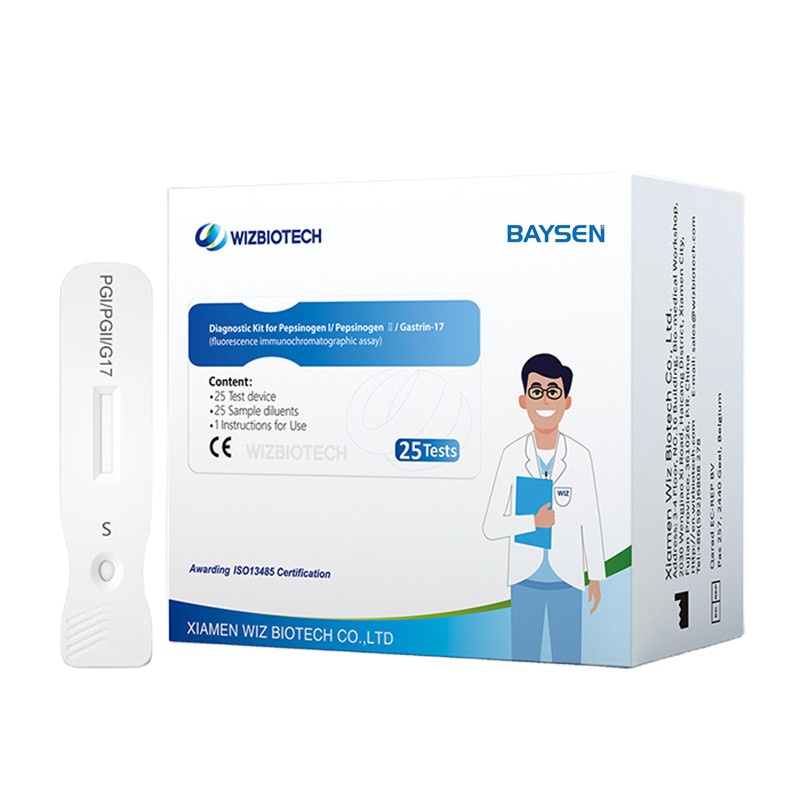
Kit de prueba rápida combinada de pepsinógeno I, pepsinógeno II y gastrina-17
Kit de diagnóstico para pepsinógeno I/pepsinógeno II/gastrina-17
Metodología: ensayo inmunocromatográfico de fluorescencia
Información de producción
| Número de modelo | G17/IGP/IGP II | Embalaje | 25 pruebas/kit, 30 kits/caja |
| Nombre | Kit de diagnóstico para pepsinógeno I/pepsinógeno II/gastrina-17 | Clasificación de instrumentos | Clase II |
| Características | Alta sensibilidad, fácil operación. | Certificado | CE/ISO13485 |
| Exactitud | > 99% | Duración | Dos años |
| Metodología | ensayo inmunocromatográfico de fluorescencia | Servicio OEM/ODM | Disponible |
USO PREVISTO
Este kit es aplicable a la detección cuantitativa in vitro de la concentración de pepsinógeno I (PGI), pepsinógeno II.
(PGII) y gastrina 17 en muestras de suero/plasma/sangre completa humana, para evaluar las células de la glándula oxíntica gástrica
Función hepática, lesión de la mucosa del fondo gástrico y gastritis atrófica. El kit solo proporciona el resultado de la prueba de pepsinógeno I.
(PGI), Pepsinógeno II (PGII) y Gastrina 17. El resultado obtenido se analizará en combinación con otros estudios clínicos.
Información. Sólo debe ser utilizado por profesionales sanitarios.
Procedimiento de prueba
| 1 | Antes de utilizar el reactivo, lea atentamente el prospecto del paquete y familiarícese con los procedimientos de operación. |
| 2 | Seleccione el modo de prueba estándar del analizador inmunológico portátil WIZ-A101. |
| 3 | Abra el paquete de reactivo envuelto en papel de aluminio y saque el dispositivo de prueba. |
| 4 | Inserte horizontalmente el dispositivo de prueba en la ranura del analizador inmunológico. |
| 5 | En la página de inicio de la interfaz de operación del analizador inmunológico, haga clic en "Estándar" para ingresar a la interfaz de prueba. |
| 6 | Haga clic en “Escaneo de control de calidad” para escanear el código QR en el lado interior del kit; ingrese los parámetros relacionados con el kit en el instrumento y Seleccione el tipo de muestra. Nota: Cada número de lote del kit se escaneará una sola vez. Si ya se ha escaneado el número de lote, omite este paso |
| 7 | Verifique la coherencia del "Nombre del producto", "Número de lote", etc. en la interfaz de prueba con la información del kit. etiqueta. |
| 8 | Después de confirmar la consistencia de la información, extraiga los diluyentes de muestra y agregue 80 µL de suero/plasma/sangre completa. Tomar una muestra y mezclar suficientemente. |
| 9 | Agregue 80 µL de la solución mezclada anteriormente mencionada en el orificio de muestra del dispositivo de prueba. |
| 10 | Después de agregar la muestra por completo, haga clic en "Tiempo" y el tiempo de prueba restante se mostrará automáticamente en la pantalla. interfaz. |
| 11 | El analizador inmunológico completará automáticamente la prueba y el análisis cuando se alcance el tiempo de prueba. |
| 12 | Cálculo y visualización de resultados Una vez completada la prueba con el analizador inmunológico, el resultado se mostrará en la interfaz de prueba o podrá verse a través de “Historial” en la página de inicio de la interfaz de operación. |
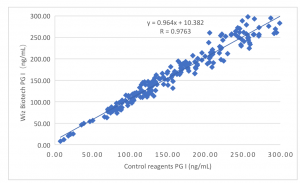
El desempeño clínico
El rendimiento de la evaluación clínica del producto se evalúa mediante la recopilación de 200 muestras clínicas. Utilice el kit comercializado de ensayo inmunoabsorbente ligado a enzimas como reactivo de control. Compare los resultados de la prueba PGI. Utilice la regresión lineal para investigar su comparabilidad. Los coeficientes de correlación de dos pruebas son y = 0,964X + 10,382 y R = 0,9763 respectivamente. Compare los resultados de la prueba PGII. Utilice la regresión lineal para investigar su comparabilidad. Los coeficientes de correlación de dos pruebas son y = 1,002X + 0,025 y R = 0,9848 respectivamente. Compare los resultados de la prueba G-17. Utilice la regresión lineal para investigar su comparabilidad. Los coeficientes de correlación de dos pruebas son y = 0,983X + 0,079 y R = 0,9864 respectivamente.
También te puede interesar: