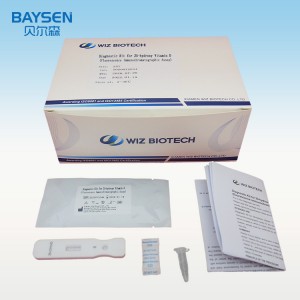
Kit de diagnóstico de anticuerpos contra el virus de la hepatitis C (ensayo inmunocromatográfico de fluorescencia)
Sólo para uso diagnóstico in vitro
Lea atentamente este prospecto antes de usar y siga estrictamente las instrucciones. No se puede garantizar la fiabilidad de los resultados del ensayo si se observan desviaciones de las instrucciones de este prospecto.
USO PREVISTO
El kit de diagnóstico de anticuerpos contra el virus de la hepatitis C (ensayo inmunocromatográfico de fluorescencia) es un ensayo inmunocromatográfico de fluorescencia para la detección cuantitativa de anticuerpos contra el VHC en suero o plasma humano, lo cual tiene un importante valor diagnóstico auxiliar para la infección por hepatitis C. Toda muestra positiva debe confirmarse mediante otras metodologías. Esta prueba es para uso exclusivo de profesionales sanitarios.
1. Deje todos los reactivos y muestras a temperatura ambiente.
2. Abra el analizador inmunológico portátil (WIZ-A101), ingrese la contraseña de inicio de sesión de la cuenta de acuerdo con el método de operación del instrumento e ingrese a la interfaz de detección.
3. Escanee el código de identificación para confirmar el elemento de prueba.
4. Saque la tarjeta de prueba de la bolsa de aluminio.
5. Inserte la tarjeta de prueba en la ranura para tarjetas, escanee el código QR y determine el elemento de prueba.
6. Agregue 20 μL de muestra de suero o plasma al diluyente de muestra y mezcle bien.
7. Agregue 80 μL de solución de muestra al pocillo de muestra de la tarjeta.
8. Haga clic en el botón "prueba estándar", después de 15 minutos, el instrumento detectará automáticamente la tarjeta de prueba, podrá leer los resultados desde la pantalla del instrumento y registrar/imprimir los resultados de la prueba.
9. Consulte las instrucciones del analizador inmunológico portátil (WIZ-A101).
RESUMEN
El virus de la hepatitis C (VHC) es un virus de ARN monocatenario de sentido positivo (9,5 kb) con envoltura, perteneciente a la familia Flaviviridae. Se han identificado seis genotipos principales y una serie de subtipos del VHC. Aislado en 1989, el VHC ahora se reconoce como la principal causa de hepatitis no A ni B asociada a transfusiones. La enfermedad se caracteriza por una forma aguda y crónica. Más del 50% de las personas infectadas desarrollan hepatitis crónica grave y potencialmente mortal con cirrosis hepática y carcinomas hepatocelulares. Desde la introducción en 1990 del cribado anti-VHC en donaciones de sangre, la incidencia de esta infección en receptores de transfusiones se ha reducido significativamente. Estudios clínicos muestran que una cantidad significativa de personas infectadas con el VHC desarrollan anticuerpos contra la proteína no estructural NS5 del virus. Para esto, las pruebas incluyen antígenos de la región NS5 del genoma viral, además de NS3 (c200), NS4 (c200) y el núcleo (c22).
PRINCIPIO DEL PROCEDIMIENTO
La membrana del dispositivo de prueba está recubierta con antígeno del VHC en la región de prueba y anticuerpo de cabra anti-IgG de conejo en la región de control. La almohadilla de la etiqueta está recubierta previamente con antígeno del VHC e IgG de conejo marcados con fluorescencia. Al analizar una muestra positiva, el anticuerpo del VHC presente en la muestra se combina con el antígeno del VHC marcado con fluorescencia y forma una mezcla inmunitaria. Mediante inmunocromatografía, el complejo fluye en dirección al papel absorbente y, al atravesar la región de prueba, se combina con el antígeno de recubrimiento del VHC, formando un nuevo complejo. El nivel de anticuerpos del VHC se correlaciona positivamente con la señal de fluorescencia, y la concentración de anticuerpos del VHC en la muestra puede detectarse mediante inmunoensayo de fluorescencia.
REACTIVOS Y MATERIALES SUMINISTRADOS
Componentes del paquete 25T:
Tarjeta de prueba envuelta individualmente en una bolsa de aluminio con un desecante.
Diluyentes de muestra
.Prospecto del paquete
MATERIALES REQUERIDOS PERO NO PROPORCIONADOS
Recipiente para recogida de muestras, temporizador
RECOGIDA Y ALMACENAMIENTO DE MUESTRAS
1. Las muestras analizadas pueden ser suero, plasma anticoagulante con heparina o plasma anticoagulante con EDTA.
2. Según las técnicas estándar, tome la muestra. La muestra de suero o plasma puede conservarse refrigerada a 2-8 °C durante 7 días y criopreservada a menos de -15 °C durante 6 meses.
3.Todas las muestras evitan los ciclos de congelación y descongelación.
PROCEDIMIENTO DE ENSAYO
Lea el manual de funcionamiento del instrumento y el prospecto antes de realizar la prueba.
Este resultado de prueba es solo para referencia clínica, no debe servir como la única base para el diagnóstico y tratamiento clínico, el manejo clínico del paciente debe ser una consideración integral combinada con sus síntomas, historial médico, otros exámenes de laboratorio, respuesta al tratamiento, epidemiología y otra información.
Este reactivo se utiliza únicamente para análisis de suero y plasma. Es posible que no se obtengan resultados precisos al utilizarlo con otras muestras, como saliva, orina, etc.
CARACTERÍSTICAS DE RENDIMIENTO
| Linealidad | 0,005-5 | desviación relativa: -15% a +15%. |
| Coeficiente de correlación lineal: (r) ≥ 0,9900 | ||
| Exactitud | La tasa de recuperación deberá estar entre el 85% – 115%. | |
| Repetibilidad | CV≤15% | |
REFERENCIAS
1. Hepatitis postransfusional. En: Moore SB, ed. Enfermedades virales transmitidas por transfusión. Alington, VA. Asociación Americana de Bancos de Sangre, págs. 53-38.
2.Hansen JH, et al. Interferencia de HAMA con inmunoensayos basados en anticuerpos monoclonales murinos[J].J of Clin Immunoassay, 1993, 16:294-299.
3. Levinson SS. La naturaleza de los anticuerpos heterofílicos y el papel en la interferencia del inmunoensayo [J]. J of Clin Immunoassay, 1992, 15:108-114.
4. Alter HJ., Purcell RH, Holland PV, et al. (1978) Agente transmisible en la hepatitis no A, no B. Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus de la hepatitis C: el principal agente causal de la hepatitis viral no A, no B. Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Ensayo inmunoabsorbente ligado a enzimas (ELISA): ensayo cualitativo de IgG. Inmunoquímica 8:871-874.
VALORES ESPERADOS
AcVHC <0,02
Se recomienda que cada laboratorio establezca su propio rango normal que represente su población de pacientes.
RESULTADOS E INTERPRETACIÓN DE LAS PRUEBAS
- Los datos anteriores son el resultado de la prueba del reactivo de anticuerpos contra el VHC, y se recomienda que cada laboratorio establezca un rango de valores de detección de anticuerpos contra el VHC adecuado para la población de esta región. Los resultados anteriores son solo de referencia.
- Los resultados de este método sólo son aplicables a los rangos de referencia establecidos en este método y no existe comparabilidad directa con otros métodos.
- Otros factores también pueden causar errores en los resultados de detección, incluidos motivos técnicos, errores operativos y otros factores de muestra.
ALMACENAMIENTO Y ESTABILIDAD
- El kit tiene una vida útil de 18 meses a partir de la fecha de fabricación. Conserve los kits no utilizados a una temperatura de 2-30 °C. NO CONGELAR. No utilizar después de la fecha de caducidad.
- No abra la bolsa sellada hasta que esté listo para realizar una prueba, y se sugiere utilizar la prueba de un solo uso en el entorno requerido (temperatura 2-35 ℃, humedad 40-90 %) dentro de los 60 minutos lo más rápido posible.
- El diluyente de muestra se utiliza inmediatamente después de abrirlo.
ADVERTENCIAS Y PRECAUCIONES
El kit debe estar sellado y protegido contra la humedad.
.Todas las muestras positivas deberán ser validadas mediante otras metodologías.
.Todas las muestras deberán ser tratadas como contaminantes potenciales.
.NO utilice reactivo vencido.
.NO intercambie reactivos entre kits con diferentes números de lote.
.NO reutilice las tarjetas de prueba ni ningún accesorio desechable.
.Un mal funcionamiento o una muestra excesiva o pequeña pueden provocar desviaciones en los resultados.
LIMITACIÓN
.Al igual que con cualquier ensayo que emplee anticuerpos murinos, existe la posibilidad de interferencia por anticuerpos humanos antirratón (HAMA) en la muestra. Las muestras de pacientes que han recibido preparaciones de anticuerpos monoclonales para diagnóstico o tratamiento pueden contener HAMA. Estas muestras pueden causar resultados falsos positivos o falsos negativos.
Clave de símbolos utilizados:
 | Dispositivo médico de diagnóstico in vitro |
 | Fabricante |
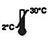 | Conservar entre 2 y 30 ℃ |
 | Fecha de expiración |
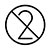 | No reutilizar |
 | PRECAUCIÓN |
 | Consulte las instrucciones de uso |