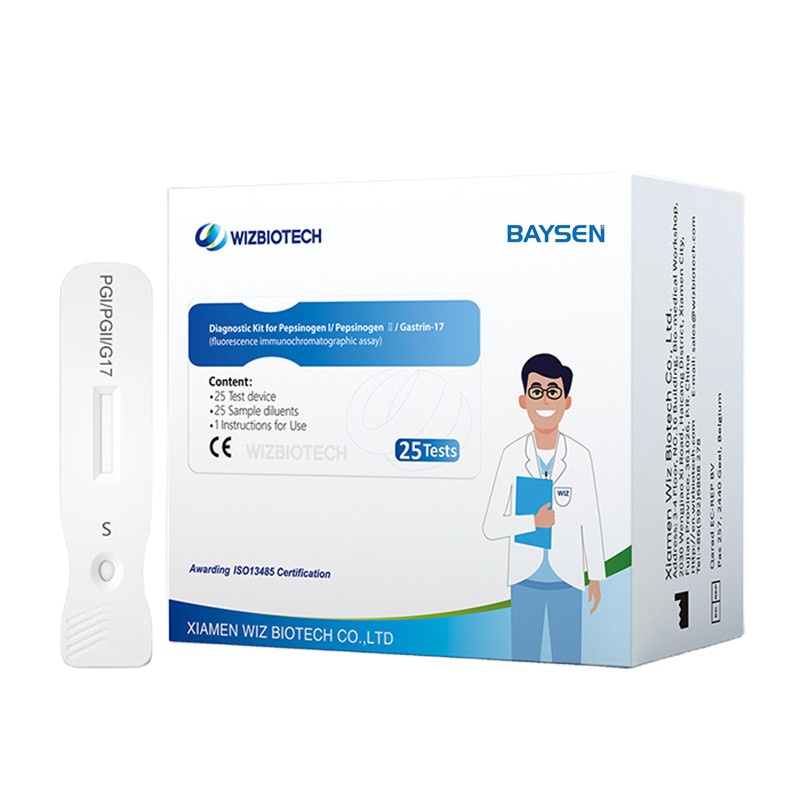
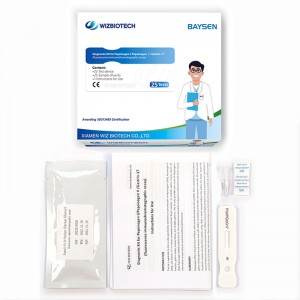
Pepsinogen I Pepsinogen II und Gastrin-17 Combo Schnelltestkit
Diagnosekit für Pepsinogen I/Pepsinogen II/Gastrin-17
Methodik: Fluoreszenz-Immunchromatographie-Test
Produktionsinformationen
| Modellnummer | G17/PGI/PGII | Verpackung | 25 Tests/Kit, 30 Kits/CTN |
| Name | Diagnosekit für Pepsinogen I/Pepsinogen II/Gastrin-17 | Instrumentenklassifizierung | Klasse II |
| Merkmale | Hohe Empfindlichkeit, einfache Bedienung | Zertifikat | CE/ ISO13485 |
| Genauigkeit | > 99 % | Haltbarkeit | Zwei Jahre |
| Methodik | Fluoreszenz-Immunchromatographie-Test | OEM/ODM-Dienst | Verfügbar |
VERWENDUNGSZWECK
Dieses Kit ist für die quantitative In-vitro-Bestimmung der Konzentration von Pepsinogen I (PGI), Pepsinogen II
(PGII) und Gastrin 17 in menschlichen Serum-/Plasma-/Vollblutproben, um die oxyntischen Drüsenzellen des Magens zu bewerten
Funktion, Magenschleimhautläsion und atrophische Gastritis. Das Kit liefert nur Testergebnisse von Pepsinogen I
(PGI), Pepsinogen II (PGII) und Gastrin 17. Das erhaltene Ergebnis soll in Kombination mit anderen klinischen
Informationen. Es darf nur von medizinischem Fachpersonal verwendet werden.
Testverfahren
| 1 | Lesen Sie vor der Verwendung des Reagenzes die Packungsbeilage sorgfältig durch und machen Sie sich mit den Bedienungsvorgängen vertraut. |
| 2 | Wählen Sie den Standardtestmodus des tragbaren Immunanalysators WIZ-A101. |
| 3 | Öffnen Sie die Reagenzpackung aus Aluminiumfolie und entnehmen Sie das Testgerät. |
| 4 | Führen Sie das Testgerät horizontal in den Schlitz des Immunanalysators ein. |
| 5 | Klicken Sie auf der Startseite der Bedienoberfläche des Immunanalysators auf „Standard“, um die Testoberfläche aufzurufen |
| 6 | Klicken Sie auf „QC Scan“, um den QR-Code auf der Innenseite des Kits zu scannen. Geben Sie die Kit-bezogenen Parameter in das Gerät ein und Wählen Sie den Probentyp aus. Hinweis: Jede Chargennummer des Kits muss einmal gescannt werden. Wenn die Chargennummer gescannt wurde, dann überspringen Sie diesen Schritt. |
| 7 | Überprüfen Sie die Konsistenz von „Produktname“, „Chargennummer“ usw. auf der Testoberfläche mit Informationen zum Kit Etikett. |
| 8 | Nachdem die Konsistenz der Informationen bestätigt wurde, entnehmen Sie die Probenverdünner und fügen Sie 80µL Serum/Plasma/Vollblut hinzu Probe entnehmen und ausreichend mischen. |
| 9 | Geben Sie 80 µl der oben gemischten Lösung in die Probenöffnung des Testgeräts. |
| 10 | Klicken Sie nach der vollständigen Probenzugabe auf „Timing“ und die verbleibende Testzeit wird automatisch auf dem Schnittstelle. |
| 11 | Der Immunanalysator schließt Test und Analyse automatisch ab, wenn die Testzeit erreicht ist. |
| 12 | Ergebnisberechnung und -anzeige Nach Abschluss des Tests mit dem Immunanalysator wird das Testergebnis auf der Testoberfläche angezeigt oder kann eingesehen werden über „Verlauf“ auf der Startseite der Bedienoberfläche. |
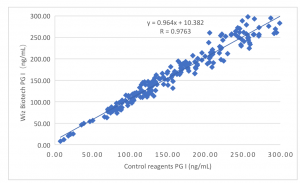
Die klinische Leistung
Die Leistung des Produkts bei der klinischen Bewertung wird durch die Entnahme von 200 klinischen Proben beurteilt. Verwenden Sie das im Handel erhältliche Kit für den Enzymimmunoassay als Kontrollreagenz. Vergleichen Sie die PGI-Testergebnisse. Verwenden Sie eine Linearitätsregression, um deren Vergleichbarkeit zu untersuchen. Die Korrelationskoeffizienten zweier Tests betragen y = 0,964X + 10,382 bzw. R=0,9763. Vergleichen Sie die PGII-Testergebnisse. Verwenden Sie eine Linearitätsregression, um deren Vergleichbarkeit zu untersuchen. Die Korrelationskoeffizienten zweier Tests betragen y = 1,002X + 0,025 bzw. R=0,9848. Vergleichen Sie die G-17-Testergebnisse. Verwenden Sie eine Linearitätsregression, um deren Vergleichbarkeit zu untersuchen. Die Korrelationskoeffizienten zweier Tests betragen y =0,983X + 0,079 bzw. R=0,9864.
Das könnte dir auch gefallen: