Diagnosekit für Gesamtthyroxin (Fluoreszenz-Immunchromatographie-Test)
Diagnosekit für Gesamtthyroxin (Fluoreszenz-Immunchromatographie-Test)
Nur zur In-vitro-Diagnostik
Bitte lesen Sie diese Packungsbeilage vor Gebrauch sorgfältig durch und befolgen Sie die Anweisungen genau. Bei Abweichungen von den Anweisungen in dieser Packungsbeilage kann die Zuverlässigkeit der Testergebnisse nicht garantiert werden.
VERWENDUNGSZWECK
Das Diagnosekit für Gesamtthyroxin (Fluoreszenz-Immunchromatographie-Test) ist ein Fluoreszenz-Immunchromatographie-Test zum quantitativen Nachweis von Gesamtthyroxin (TT4) in menschlichem Serum oder Plasma, der hauptsächlich zur Beurteilung der Schilddrüsenfunktion verwendet wird. Es dient als unterstützendes Diagnosereagenz. Alle positiven Proben müssen durch andere Methoden bestätigt werden. Dieser Test ist nur für die Anwendung durch medizinisches Fachpersonal bestimmt.
ZUSAMMENFASSUNG
Thyroxin (T4) wird von der Schilddrüse ausgeschüttet und hat ein Molekulargewicht von 777D. Der Gesamt-T4-Spiegel (Gesamt-T4, TT4) im Serum ist 50-mal so hoch wie der Serum-T3-Spiegel. TT4 bindet zu 99,9 % an Thyroxin-bindende Proteine (TBP) im Serum, der freie T4-Spiegel (Freies T4, FT4) liegt unter 0,05 %. T4 und T3 sind an der Regulierung des Stoffwechsels beteiligt. TT4-Messungen dienen der Beurteilung des Schilddrüsenfunktionszustands und der Diagnose von Erkrankungen. Klinisch ist TT4 ein zuverlässiger Indikator für die Diagnose und Wirksamkeitsüberwachung von Hyperthyreose und Hypothyreose.
PRINZIP DES VERFAHRENS
Die Membran des Testgeräts ist im Testbereich mit einem Konjugat aus BSA und T4 und im Kontrollbereich mit Ziegen-Anti-Kaninchen-IgG-Antikörpern beschichtet. Das Markierungspad ist vorab mit fluoreszenzmarkierten Anti-T4-Antikörpern und Kaninchen-IgG beschichtet. Beim Testen der Probe verbindet sich TT4 in der Probe mit fluoreszenzmarkierten Anti-T4-Antikörpern und bildet ein Immungemisch. Durch die Immunchromatographie fließt der Komplex in Richtung des saugfähigen Papiers. Wenn der Komplex den Testbereich passiert, verbindet sich der freie Fluoreszenzmarker mit T4 auf der Membran. Die TT4-Konzentration korreliert negativ mit dem Fluoreszenzsignal und kann durch einen Fluoreszenzimmunassay nachgewiesen werden.
Mitgelieferte Reagenzien und Materialien
25T-Paketkomponenten:
.Testkarte einzeln in Folie verpackt mit einem Trockenmittel 25T
.Eine Lösung 25T
.B Lösung 1
.Packungsbeilage 1
BENÖTIGTE, ABER NICHT MITGELIEFERTE MATERIALIEN
Probensammelbehälter, Timer
Probenentnahme und -aufbewahrung
1. Bei den getesteten Proben kann es sich um Serum, Heparin-Antikoagulans-Plasma oder EDTA-Antikoagulans-Plasma handeln.
2. Entnehmen Sie die Probe gemäß Standardtechniken. Serum- oder Plasmaproben können 7 Tage lang bei 2–8 °C gekühlt und 6 Monate lang bei unter –15 °C kryokonserviert werden.
3. Vermeiden Sie bei allen Proben Gefrier- und Auftauzyklen.
TESTVERFAHREN
Die Testdurchführung des Geräts finden Sie im Handbuch des Immunoanalyzers. Die Reagenzientestdurchführung ist wie folgt
1. Alle Reagenzien und Proben beiseite legen und auf Raumtemperatur abkühlen lassen.
2. Öffnen Sie den tragbaren Immunanalysator (WIZ-A101), geben Sie das Kontokennwort entsprechend der Betriebsmethode des Instruments ein und rufen Sie die Erkennungsschnittstelle auf.
3.Scannen Sie den Identifikationscode, um den Testartikel zu bestätigen.
3. Nehmen Sie die Testkarte aus der Folientüte.
4. Stecken Sie die Testkarte in den Kartenschlitz, scannen Sie den QR-Code und bestimmen Sie den Testgegenstand.
5. Fügen Sie der Lösung A 20 μl Serum- oder Plasmaprobe hinzu und mischen Sie gut.
6. Fügen Sie der obigen Mischung 20 μl B-Lösung hinzu und mischen Sie gut.
Lassen Sie die Mischung für20Minuten.
Geben Sie 80 μl der Mischung in die Probenvertiefung der Karte.
Klicken Sie auf die Schaltfläche „Standardtest“. Nach 10 Minuten erkennt das Gerät die Testkarte automatisch, kann die Ergebnisse vom Anzeigebildschirm des Geräts ablesen und die Testergebnisse aufzeichnen/ausdrucken.
Beachten Sie die Anleitung zum tragbaren Immunanalysator (WIZ-A101).
ERWARTETE WERTE
TT4-Normalbereich: 55–140 nmol/l
Es wird empfohlen, dass jedes Labor seinen eigenen Normalbereich festlegt, der seine Patientenpopulation repräsentiert.
TESTERGEBNISSE UND INTERPRETATION
Die obigen Daten stellen das Referenzintervall dar, das für die Nachweisdaten dieses Kits festgelegt wurde. Es wird empfohlen, dass jedes Labor ein Referenzintervall für die relevante klinische Bedeutung der Bevölkerung in dieser Region festlegt.
Die TT4-Konzentration liegt über dem Referenzbereich und physiologische Veränderungen oder Stressreaktionen sollten ausgeschlossen werden. Bei einer tatsächlichen Anomalie sollte eine Diagnose mit klinischen Symptomen kombiniert werden.
Die Ergebnisse dieser Methode sind nur auf den mit dieser Methode festgelegten Referenzbereich anwendbar und die Ergebnisse sind nicht direkt mit anderen Methoden vergleichbar.
Auch andere Faktoren können zu Fehlern in den Erkennungsergebnissen führen, darunter technische Gründe, Betriebsfehler und andere Stichprobenfaktoren.
LAGERUNG UND STABILITÄT
Das Kit ist ab Herstellungsdatum 18 Monate haltbar. Unbenutzte Kits bei 2–30 °C lagern. NICHT EINFRIEREN. Nach Ablauf des Verfallsdatums nicht mehr verwenden.
Öffnen Sie den versiegelten Beutel erst, wenn Sie bereit sind, einen Test durchzuführen. Es wird empfohlen, den Einmaltest so schnell wie möglich innerhalb von 60 Minuten in der erforderlichen Umgebung (Temperatur 2–35 °C, Luftfeuchtigkeit 40–90 %) durchzuführen.
.Probenverdünner wird sofort nach dem Öffnen verwendet.
WARNHINWEISE UND VORSICHTSMASSNAHMEN
.Das Kit sollte versiegelt und vor Feuchtigkeit geschützt werden.
.Alle positiven Proben müssen durch andere Methoden validiert werden.
.Alle Proben sind als potenzielle Schadstoffe zu behandeln.
.Verwenden Sie KEIN abgelaufenes Reagenz.
.Tauschen Sie Reagenzien NICHT zwischen Kits mit unterschiedlichen Chargennummern aus.
.Testkarten und Einwegzubehör NICHT wiederverwenden.
.Fehlbedienungen, zu große oder zu kleine Probenmengen können zu Ergebnisabweichungen führen.
LNACHAHMUNG
Wie bei jedem Test mit Maus-Antikörpern besteht die Möglichkeit einer Interferenz durch humane Anti-Maus-Antikörper (HAMA) in der Probe. Proben von Patienten, die monoklonale Antikörperpräparate zur Diagnose oder Therapie erhalten haben, können HAMA enthalten. Solche Proben können falsch positive oder falsch negative Ergebnisse verursachen.
Dieses Testergebnis dient nur als klinische Referenz und sollte nicht als einzige Grundlage für die klinische Diagnose und Behandlung dienen. Die klinische Behandlung des Patienten sollte umfassend unter Berücksichtigung seiner Symptome, der Krankengeschichte, anderer Laboruntersuchungen, des Behandlungserfolgs, der Epidemiologie und anderer Informationen erfolgen.
Dieses Reagenz wird nur für Serum- und Plasmatests verwendet. Bei Verwendung für andere Proben wie Speichel, Urin usw. werden möglicherweise keine genauen Ergebnisse erzielt.
LEISTUNGSMERKMALE
| Linearität | 20 nmol/l bis 320 nmol/l | relative Abweichung: -15 % bis +15 %. |
| Linearer Korrelationskoeffizient: (r) ≥ 0,9900 | ||
| Genauigkeit | Die Rückgewinnungsrate muss zwischen 85 % und 115 % liegen. | |
| Wiederholbarkeit | CV ≤ 15 % | |
| Spezifität(Keine der getesteten Störsubstanzen störte den Test) | Interferent | Störkonzentration |
| Hämoglobin | 200 μg/ml | |
| Transferrin | 100 μg/ml | |
| Meerrettichperoxidase | 2000 μg/ml | |
| rT3 | 100 ng/ml | |
| T3 | 500 ng/ml | |
RReferenzen
1.Hansen JH, et al. HAMA-Interferenz mit murinen monoklonalen Antikörpern-basierten Immunoassays[J].J of Clin Immunoassay,1993,16:294-299.
2.Levinson SS. Die Natur heterophiler Antikörper und die Rolle bei der Interferenz von Immunassays [J].J of Clin Immunoassay,1992,15:108-114.
Legende der verwendeten Symbole:
 | In-vitro-Diagnostikum |
 | Hersteller |
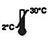 | Bei 2–30 °C lagern |
 | Verfallsdatum |
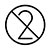 | Nicht wiederverwenden |
 | VORSICHT |
 | Gebrauchsanweisung beachten |
Xiamen Wiz Biotech CO., LTD
Adresse: 3.–4. Stock, Gebäude Nr. 16, Biomedizinische Werkstatt, Wengjiao West Road 2030, Bezirk Haicang, 361026, Xiamen, China
Tel:+86-592-6808278
Fax: +86-592-6808279