Diagnosekit für Antigen gegen Helicobacter Pylori (Fluoreszenz-Immunchromatographie-Test)
Diagnosekit für Antigen gegen Helicobacter Pylori(Fluoreszenzimmunchromatographischer Test)
Nur zur In-vitro-Diagnostik
Bitte lesen Sie diese Packungsbeilage vor Gebrauch sorgfältig durch und befolgen Sie die Anweisungen genau. Bei Abweichungen von den Anweisungen in dieser Packungsbeilage kann die Zuverlässigkeit der Testergebnisse nicht garantiert werden.
VERWENDUNGSZWECK
Das Diagnosekit für Helicobacter-pylori-Antigen (Fluoreszenzimmunchromatographie) eignet sich zum quantitativen Nachweis des HP-Antigens im menschlichen Stuhl mittels Fluoreszenzimmunchromatographie und hat einen wichtigen zusätzlichen diagnostischen Wert bei Mageninfektionen. Alle positiven Proben müssen durch andere Methoden bestätigt werden. Dieser Test ist nur für die Anwendung durch medizinisches Fachpersonal bestimmt.
ZUSAMMENFASSUNG
Eine Infektion mit Helicobacter pylori im Magen steht in engem Zusammenhang mit chronischer Gastritis, Magengeschwüren, Magenadenokarzinomen, Magenschleimhaut-assoziiertem Lymphom. Die Infektionsrate mit H. pylori beträgt bei Patienten mit Gastritis, Magengeschwüren, Zwölffingerdarmgeschwüren und Magenkrebs etwa 90 %. Die Weltgesundheitsorganisation hat H. pylori als ersten krebserregenden Faktor identifiziert und stellt eindeutig einen Risikofaktor für Magenkrebs dar. Der Nachweis von H. pylori ist für die Diagnose einer H. pylori-Infektion von großem Wert. Der Test basiert auf der Fluoreszenz-Immunchromatographie-Analysetechnik und kann innerhalb von 15 Minuten ein Ergebnis liefern.
PRINZIP DES VERFAHRENS
Der Teststreifen ist mit einem Anti-HP-Antikörper beschichtet, der zuvor an der Membranchromatographie befestigt wurde. Das Etikettenpad ist mit einem fluoreszenzmarkierten Anti-HP-Antikörper beschichtet. Bei der Prüfung einer positiven Probe kann das HP in der Probe mit dem fluoreszenzmarkierten Anti-HP-Antikörper gemischt werden, wodurch eine Immunmischung entsteht. Während die Mischung über den Teststreifen wandert, wird der HP-Konjugatkomplex vom Anti-HP-Antikörper auf der Membran eingefangen und bildet einen Komplex. Die Fluoreszenzintensität korreliert positiv mit dem HP-Gehalt. Das HP in der Probe kann mit einem Fluoreszenz-Immunoassay-Analysator nachgewiesen werden.
Mitgelieferte Reagenzien und Materialien
25T-Paketkomponenten:
Testkarte einzeln in Folie verpackt mit einem Trockenmittel 25T
Probenverdünner 25T
Packungsbeilage 1
BENÖTIGTE, ABER NICHT MITGELIEFERTE MATERIALIEN
Probensammelbehälter, Timer
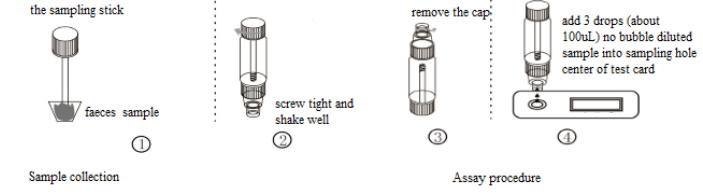
Probenentnahme und -aufbewahrung
1. Verwenden Sie einen sauberen Einwegbehälter, um frische Stuhlproben zu sammeln und sofort zu testen. Wenn die Probe nicht sofort getestet werden kann, lagern Sie sie bitte 3 Tage lang bei 2–8 °C oder 6 Monate lang bei unter -15 °C.
2. Nehmen Sie den Probenentnahmestab heraus, stecken Sie ihn in die Stuhlprobe, wiederholen Sie den Vorgang dreimal und entnehmen Sie jedes Mal unterschiedliche Teile der Stuhlprobe. Setzen Sie den Probenentnahmestab dann wieder ein, schrauben Sie ihn fest und schütteln Sie ihn gut. Oder entnehmen Sie mit dem Probenentnahmestab etwa 50 mg Stuhlprobe, geben Sie ihn in ein Stuhlprobenröhrchen mit der Probenverdünnung und schrauben Sie ihn fest.
3. Nehmen Sie mit einer Einwegpipette eine Stuhlprobe vom Durchfallpatienten, geben Sie dann 3 Tropfen (ca. 100 µl) in das Stuhlprobenröhrchen und schütteln Sie es gut.
Hinweise:
1. Vermeiden Sie Gefrier-Tau-Zyklen.
2. Proben vor Gebrauch auf Raumtemperatur auftauen.
TESTVERFAHREN
Bitte lesen Sie vor dem Test die Bedienungsanleitung und die Packungsbeilage des Geräts.
1. Alle Reagenzien und Proben beiseite legen und auf Raumtemperatur abkühlen lassen.
2. Öffnen Sie den tragbaren Immunanalysator (WIZ-A101), geben Sie das Kontokennwort entsprechend der Betriebsmethode des Instruments ein und rufen Sie die Erkennungsschnittstelle auf.
3.Scannen Sie den Identifikationscode, um den Testartikel zu bestätigen.
4. Nehmen Sie die Testkarte aus der Folientüte.
5. Stecken Sie die Testkarte in den Kartenschlitz, scannen Sie den QR-Code und bestimmen Sie den Testgegenstand.
6. Entfernen Sie die Kappe vom Probenröhrchen und entsorgen Sie die ersten zwei Tropfen der verdünnten Probe. Geben Sie 3 Tropfen (ca. 100 µl) der blasenfreien verdünnten Probe mit der mitgelieferten Dispette vertikal und langsam in die Probenvertiefung der Karte.
7. Klicken Sie auf die Schaltfläche „Standardtest“. Nach 15 Minuten erkennt das Gerät die Testkarte automatisch, kann die Ergebnisse vom Anzeigebildschirm des Geräts ablesen und die Testergebnisse aufzeichnen/ausdrucken.
8. Beachten Sie die Anweisungen zum tragbaren Immunanalysator (WIZ-A101).
ERWARTETE WERTE
HP-Ag<10
Es wird empfohlen, dass jedes Labor seinen eigenen Normalbereich festlegt, der seine Patientenpopulation repräsentiert.
TESTERGEBNISSE UND INTERPRETATION
1. Der HP-Ag-Wert in der Probe liegt über 10 und sollte eine Veränderung des physiologischen Zustands ausschließen. Die Ergebnisse sind tatsächlich abnormal und sollten anhand klinischer Symptome diagnostiziert werden.
2. Die Ergebnisse dieser Methode sind nur auf die in dieser Methode festgelegten Referenzbereiche anwendbar und es besteht keine direkte Vergleichbarkeit mit anderen Methoden.
3. Auch andere Faktoren können zu Fehlern in den Erkennungsergebnissen führen, darunter technische Gründe, Betriebsfehler und andere Stichprobenfaktoren.
LAGERUNG UND STABILITÄT
1. Das Kit ist ab Herstellungsdatum 18 Monate haltbar. Unbenutzte Kits bei 2–30 °C lagern. NICHT EINFRIEREN. Nach Ablauf des Verfallsdatums nicht mehr verwenden.
2. Öffnen Sie den versiegelten Beutel erst, wenn Sie bereit sind, einen Test durchzuführen. Es wird empfohlen, den Einmaltest so schnell wie möglich innerhalb von 60 Minuten in der erforderlichen Umgebung (Temperatur 2–35 °C, Luftfeuchtigkeit 40–90 %) durchzuführen.
3. Das Probenverdünnungsmittel wird unmittelbar nach dem Öffnen verwendet.
WARNHINWEISE UND VORSICHTSMASSNAHMEN
.Das Kit sollte versiegelt und vor Feuchtigkeit geschützt werden.
.Alle positiven Proben müssen durch andere Methoden validiert werden.
.Alle Proben sind als potenzielle Schadstoffe zu behandeln.
.Verwenden Sie KEIN abgelaufenes Reagenz.
.Tauschen Sie Reagenzien NICHT zwischen Kits mit unterschiedlichen Chargennummern aus.
.Testkarten und Einwegzubehör NICHT wiederverwenden.
.Fehlbedienungen, zu große oder zu kleine Probenmengen können zu Ergebnisabweichungen führen.
LNACHAHMUNG
Wie bei jedem Test mit Maus-Antikörpern besteht die Möglichkeit einer Interferenz durch humane Anti-Maus-Antikörper (HAMA) in der Probe. Proben von Patienten, die monoklonale Antikörperpräparate zur Diagnose oder Therapie erhalten haben, können HAMA enthalten. Solche Proben können falsch positive oder falsch negative Ergebnisse verursachen.
Dieses Testergebnis dient nur als klinische Referenz und sollte nicht als einzige Grundlage für die klinische Diagnose und Behandlung dienen. Die klinische Behandlung des Patienten sollte umfassend unter Berücksichtigung seiner Symptome, der Krankengeschichte, anderer Laboruntersuchungen, des Behandlungserfolgs, der Epidemiologie und anderer Informationen erfolgen.
Dieses Reagenz wird nur für Stuhltests verwendet. Bei Verwendung für andere Proben wie Speichel, Urin usw. liefert es möglicherweise keine genauen Ergebnisse.
LEISTUNGSMERKMALE
| Linearität | 10-1000 | relative Abweichung: -15 % bis +15 %. |
| Linearer Korrelationskoeffizient: (r) ≥ 0,9900 | ||
| Genauigkeit | Die Rückgewinnungsrate muss zwischen 85 % und 115 % liegen. | |
| Wiederholbarkeit | CV ≤ 15 % | |
RReferenzen
1.Shao,JL&F.Wu.Neueste Fortschritte bei den Nachweismethoden von Helicobacter pylori[J].Journal of Gastroenterology and Hepatology,2012,21(8):691-694
2.Hansen JH, et al. HAMA-Interferenz mit murinen monoklonalen Antikörpern-basierten Immunoassays[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS. Die Natur heterophiler Antikörper und die Rolle bei der Interferenz von Immunassays [J].J of Clin Immunoassay,1992,15:108-114.
Legende der verwendeten Symbole:
 | In-vitro-Diagnostikum |
 | Hersteller |
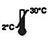 | Bei 2–30 °C lagern |
 | Verfallsdatum |
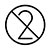 | Nicht wiederverwenden |
 | VORSICHT |
 | Gebrauchsanweisung beachten |
Xiamen Wiz Biotech CO., LTD
Adresse: 3.–4. Stock, Gebäude Nr. 16, Biomedizinische Werkstatt, Wengjiao West Road 2030, Bezirk Haicang, 361026, Xiamen, China
Tel:+86-592-6808278
Fax: +86-592-6808279