China-Fabrik für medizinische Laborreagenzien in China HIV-Testkit-Schnelltesthersteller
„Aufrichtigkeit, Innovation, Genauigkeit und Effizienz“ könnten die beständige Konzeption unserer Organisation sein, um langfristig gemeinsam mit Käufern auf der Grundlage gegenseitiger Gegenseitigkeit und gegenseitigen Gewinns für die chinesische Fabrik für den chinesischen Hersteller von HIV-Testkit-Schnelltests für medizinische Laborreagenzien zu produzieren. Wir heißen neue und ehemalige Kunden aus allen Lebensbereichen willkommen, uns für zukünftige Geschäftsinteraktionen anzurufen und gemeinsame Erfolge zu erzielen!
„Aufrichtigkeit, Innovation, Strenge und Effizienz“ könnten die beständige Konzeption unserer Organisation für die langfristige Zusammenarbeit mit Käufern für gegenseitige Gegenseitigkeit und gegenseitigen Nutzen sein fürChina HIV-Test der 4. Generation, Schneller HIV-Test der 4. GenerationMit dem Ziel „Null Fehler“. Der Schutz der Umwelt und der sozialen Erträge sowie die soziale Verantwortung der Mitarbeiter sind unsere eigene Pflicht. Wir heißen Freunde aus aller Welt willkommen, die uns besuchen und beraten, damit wir gemeinsam das Win-Win-Ziel erreichen können.
Nur zur In-vitro-Diagnostik
Bitte lesen Sie diese Packungsbeilage vor Gebrauch sorgfältig durch und befolgen Sie die Anweisungen genau. Bei Abweichungen von den Anweisungen in dieser Packungsbeilage kann die Zuverlässigkeit der Testergebnisse nicht garantiert werden.
VERWENDUNGSZWECK
Das Diagnosekit für Hepatitis-C-Virus-Antikörper (Fluoreszenz-Immunchromatographie-Test) ist ein Fluoreszenz-Immunchromatographie-Test zum quantitativen Nachweis von HCV-Antikörpern in menschlichem Serum oder Plasma. Dies ist ein wichtiger diagnostischer Zusatzwert für eine Hepatitis-C-Infektion. Alle positiven Proben müssen durch andere Methoden bestätigt werden. Dieser Test ist nur für medizinisches Fachpersonal bestimmt.
1. Alle Reagenzien und Proben beiseite legen und auf Raumtemperatur abkühlen lassen.
2. Öffnen Sie den tragbaren Immunanalysator (WIZ-A101), geben Sie das Kontokennwort entsprechend der Betriebsmethode des Instruments ein und rufen Sie die Erkennungsschnittstelle auf.
3.Scannen Sie den Identifikationscode, um den Testartikel zu bestätigen.
4. Nehmen Sie die Testkarte aus der Folientüte.
5. Stecken Sie die Testkarte in den Kartenschlitz, scannen Sie den QR-Code und bestimmen Sie den Testgegenstand.
6. Geben Sie 20 μl Serum- oder Plasmaprobe zum Probenverdünner und mischen Sie gut.
7. Geben Sie 80 μl Probenlösung in die Probenvertiefung der Karte.
8. Klicken Sie auf die Schaltfläche „Standardtest“. Nach 15 Minuten erkennt das Gerät die Testkarte automatisch, kann die Ergebnisse vom Anzeigebildschirm des Geräts ablesen und die Testergebnisse aufzeichnen/ausdrucken.
9. Beachten Sie die Anweisungen zum tragbaren Immunanalysator (WIZ-A101).
ZUSAMMENFASSUNG
Das Hepatitis-C-Virus (HCV) ist ein behülltes, einzelsträngiges Positiv-RNA-Virus (9,5 kb) aus der Familie der Flaviviridae. Es wurden sechs Hauptgenotypen und eine Reihe von HCV-Subtypen identifiziert. Das 1989 isolierte HCV gilt heute als Hauptursache für transfusionsassoziierte Hepatitis C (Non-A/Non-B). Die Krankheit ist in einen akuten und einen chronischen Verlauf unterteilt. Über 50 % der Infizierten entwickeln eine schwere, lebensbedrohliche chronische Hepatitis mit Leberzirrhose und hepatozellulärem Karzinom. Seit der Einführung des HCV-Screenings bei Blutspenden im Jahr 1990 konnte die Häufigkeit dieser Infektion bei Transfusionsempfängern deutlich reduziert werden. Klinische Studien zeigen, dass eine signifikante Anzahl HCV-infizierter Personen Antikörper gegen das Nichtstrukturprotein NS5 des Virus entwickelt. Hierzu umfassen die Tests neben NS3 (c200), NS4 (c200) und dem Core (c22) auch Antigene aus der NS5-Region des viralen Genoms.
PRINZIP DES VERFAHRENS
Die Membran des Testgeräts ist im Testbereich mit HCV-Antigen und im Kontrollbereich mit Ziegen-Anti-Kaninchen-IgG-Antikörpern beschichtet. Das Etikettenpad ist vorab mit fluoreszenzmarkiertem HCV-Antigen und Kaninchen-IgG beschichtet. Bei positivem Testergebnis verbinden sich die HCV-Antikörper in der Probe mit dem fluoreszenzmarkierten HCV-Antigen und bilden ein Immungemisch. Durch die Immunchromatographie fließt der Komplex in Richtung des saugfähigen Papiers. Wenn der Komplex den Testbereich passiert, verbindet er sich mit dem HCV-Antigen-beschichteten Antigen und bildet einen neuen Komplex. Der HCV-Antikörperspiegel korreliert positiv mit dem Fluoreszenzsignal, und die HCV-Antikörperkonzentration in der Probe kann mittels Fluoreszenz-Immunoassay nachgewiesen werden.
Mitgelieferte Reagenzien und Materialien
25T-Paketkomponenten:
.Testkarte einzeln in Folie verpackt mit Trockenmittel
.Probenverdünner
.Packungsbeilage
BENÖTIGTE, ABER NICHT MITGELIEFERTE MATERIALIEN
Probensammelbehälter, Timer
Probenentnahme und -aufbewahrung
1. Bei den getesteten Proben kann es sich um Serum, Heparin-Antikoagulans-Plasma oder EDTA-Antikoagulans-Plasma handeln.
2. Entnehmen Sie die Probe gemäß den Standardverfahren. Serum- oder Plasmaproben können 7 Tage lang bei 2–8 °C gekühlt und 6 Monate lang bei unter -15 °C kryokonserviert werden.
3. Vermeiden Sie bei allen Proben Gefrier- und Auftauzyklen.
TESTVERFAHREN
Bitte lesen Sie vor dem Test die Bedienungsanleitung und die Packungsbeilage des Geräts.
Dieses Testergebnis dient nur als klinische Referenz und sollte nicht als einzige Grundlage für die klinische Diagnose und Behandlung dienen. Die klinische Behandlung des Patienten sollte umfassend unter Berücksichtigung seiner Symptome, der Krankengeschichte, anderer Laboruntersuchungen, des Behandlungserfolgs, der Epidemiologie und anderer Informationen erfolgen.
Dieses Reagenz wird nur für Serum- und Plasmatests verwendet. Bei Verwendung für andere Proben wie Speichel, Urin usw. werden möglicherweise keine genauen Ergebnisse erzielt.
LEISTUNGSMERKMALE
| Linearität | 0,005-5 | relative Abweichung: -15 % bis +15 %. |
| Linearer Korrelationskoeffizient: (r) ≥ 0,9900 | ||
| Genauigkeit | Die Rückgewinnungsrate muss zwischen 85 % und 115 % liegen. | |
| Wiederholbarkeit | CV ≤ 15 % | |
REFERENZEN
1. Posttransfusionshepatitis. In: Moore SB (Hrsg.), Transfusion-Transmitted Viral Diseases. Alington, VA. Am. Assoc. Blood Banks, S. 53-38.
2.Hansen JH, et al. HAMA-Interferenz mit murinen monoklonalen Antikörpern-basierten Immunoassays[J].J of Clin Immunoassay,1993,16:294-299.
3.Levinson SS. Die Natur heterophiler Antikörper und die Rolle bei der Interferenz von Immunassays [J].J of Clin Immunoassay,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, et al. (1978) Übertragbarer Erreger bei Nicht-A-, Nicht-B-Hepatitis. Lancet I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Hepatitis C Virus: der Hauptverursacher der viralen Nicht-A- und Nicht-B-Hepatitis. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Enzyme linked immunosorbent assay (ELISA):qualitativer Test von IgG. Immunochemistry 8:871-874.
ERWARTETE WERTE
HCV-Ab<0,02
Es wird empfohlen, dass jedes Labor seinen eigenen Normalbereich festlegt, der seine Patientenpopulation repräsentiert.
TESTERGEBNISSE UND INTERPRETATION
- Die obigen Daten sind das Ergebnis eines HCV-Ab-Reagenztests. Es wird empfohlen, dass jedes Labor einen für die Bevölkerung in dieser Region geeigneten Bereich von HCV-Ab-Nachweiswerten festlegt. Die obigen Ergebnisse dienen nur als Referenz.
- Die Ergebnisse dieser Methode sind nur auf die in dieser Methode festgelegten Referenzbereiche anwendbar und es besteht keine direkte Vergleichbarkeit mit anderen Methoden.
- Auch andere Faktoren können zu Fehlern in den Erkennungsergebnissen führen, darunter technische Gründe, Betriebsfehler und andere Stichprobenfaktoren.
LAGERUNG UND STABILITÄT
- Das Kit ist ab Herstellungsdatum 18 Monate haltbar. Unbenutzte Kits bei 2–30 °C lagern. NICHT EINFRIEREN. Nach Ablauf des Verfallsdatums nicht mehr verwenden.
- Öffnen Sie den versiegelten Beutel erst, wenn Sie bereit sind, einen Test durchzuführen. Es wird empfohlen, den Einmaltest so schnell wie möglich innerhalb von 60 Minuten in der erforderlichen Umgebung (Temperatur 2–35 °C, Luftfeuchtigkeit 40–90 %) durchzuführen.
- Das Probenverdünnungsmittel wird nach dem Öffnen sofort verwendet.
WARNHINWEISE UND VORSICHTSMASSNAHMEN
.Das Kit sollte versiegelt und vor Feuchtigkeit geschützt werden.
.Alle positiven Proben müssen durch andere Methoden validiert werden.
.Alle Proben sind als potenzielle Schadstoffe zu behandeln.
.Verwenden Sie KEIN abgelaufenes Reagenz.
.Tauschen Sie Reagenzien NICHT zwischen Kits mit unterschiedlichen Chargennummern aus.
.Testkarten und Einwegzubehör NICHT wiederverwenden.
.Fehlbedienungen, zu große oder zu kleine Probenmengen können zu Ergebnisabweichungen führen.
LNACHAHMUNG
.Wie bei jedem Test mit Maus-Antikörpern besteht die Möglichkeit einer Interferenz durch humane Anti-Maus-Antikörper (HAMA) in der Probe. Proben von Patienten, die monoklonale Antikörperpräparate zur Diagnose oder Therapie erhalten haben, können HAMA enthalten. Solche Proben können zu falsch positiven oder falsch negativen Ergebnissen führen.
Legende der verwendeten Symbole:
 | In-vitro-Diagnostikum |
 | Hersteller |
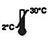 | Bei 2–30 °C lagern |
 | Verfallsdatum |
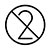 | Nicht wiederverwenden |
 | VORSICHT |
 | Gebrauchsanweisung beachten |