Nova consegna per a Cina Kit di test HBV per e malatie infettive (HBSAG HIV HCV, HBCAB HBEAG HBEAB HBCAB) Kit di test diagnosticu rapidu HBsAb / Cassetta di strisce di test di anticorpi di superficie HBsAb per l'epatite B
L'esperienze incredibilmente ricche di amministrazione di prughjetti è u mudellu di serviziu una persona à 1 rendenu l'impurtanza sustanziale di a cumunicazione urganizativa è a nostra faciule comprensione di e vostre aspettative per a Nova Consegna per u Kit di Test HBV per e Malatie Infettive in Cina (HBSAG HIV HCV, HBCAB HBEAG HBEAB HBCAB) Kit di Test Diagnostico Rapidu HBsAb / Cassetta di Strisce di Test di Anticorpi di Superficie per l'Epatite B, Cù una vasta gamma, alta qualità, prezzi ragionevuli è disinni eleganti, i nostri prudutti sò ampiamente usati cù queste industrie è altre industrie.
L'esperienze incredibilmente ricche di amministrazione di prughjetti è u mudellu di serviziu unu à unu rendenu l'impurtanza sustanziale di a cumunicazione urganizativa è a nostra faciule comprensione di e vostre aspettative.Epatite B cinese, Kit di test HBsAbSè ci date una lista di prudutti chì vi interessanu, cù e marche è i mudelli, pudemu mandà vi preventivi. Mandate ci un email direttamente. U nostru scopu hè di stabilisce relazioni cummerciale à longu andà è mutuamente prufittuose cù clienti naziunali è stranieri. Aspittemu di riceve prestu a vostra risposta.
Solu per usu diagnosticu in vitro
Leghjite attentamente stu fogliettinu illustrativu prima di l'usu è seguitate scrupolosamente l'istruzzioni. L'affidabilità di i risultati di l'analisi ùn pò esse garantita s'ellu ci sò qualchì deviazione da l'istruzzioni in questu fogliettinu illustrativu.
USU PREVISTU
U Kit Diagnosticu per l'Anticorpu di u Virus di l'Epatite C (Test Immunocromatograficu di Fluorescenza) hè un test immunocromatograficu di fluorescenza per a rilevazione quantitativa di l'anticorpi HCV in u serum o plasma umanu, chì hè un valore diagnosticu ausiliariu impurtante per l'infezzione da epatite C. Tutti i campioni pusitivi devenu esse cunfirmati da altre metodologie. Stu test hè destinatu solu à l'usu prufessiunale di a salute.
1. Lasciate da parte tutti i reagenti è i campioni à temperatura ambiente.
2. Aprite l'Analizzatore Immunitariu Portatile (WIZ-A101), inserite a password di login di u contu secondu u metudu di funziunamentu di u strumentu è accede à l'interfaccia di rilevazione.
3. Scannate u codice d'identificazione per cunfirmà l'articulu di prova.
4. Toglie a carta di prova da u sacchettu di foglia d'aluminiu.
5. Inserite a carta di prova in a fessura di a carta, scansate u codice QR è determinate l'elementu di prova.
6. Aghjunghjite 20 μL di campione di serumu o di plasma à u diluente di campione è mischiate bè.
7. Aghjunghjite 80 μL di suluzione campione à u pozzettu di campione di a carta.
8. Cliccate nant'à u buttone "test standard", dopu à 15 minuti, u strumentu rileverà automaticamente a carta di test, pò leghje i risultati da u schermu di u strumentu, è arregistrà/stampà i risultati di u test.
9. Cunsultate l'istruzzioni di l'analizatore immune portatile (WIZ-A101).
RIASSUNTU
U virus di l'epatite C (HCV) hè un virus à RNA di sensu pusitivu à catena unica (9,5 kb) di involucru chì appartene à a famiglia di i Flaviviridae. Sei genotipi principali è serie di sottotipi di HCV sò stati identificati. Isolatu in u 1989, l'HCV hè oghje ricunnisciutu cum'è a causa principale di l'epatite non A, non B assuciata à a trasfusione. A malatia hè carattarizata da una forma acuta è cronica. Più di u 50% di l'individui infettati sviluppanu epatite cronica severa è periculosa per a vita cù cirrosi epatica è carcinomi epatocellulari. Dapoi l'introduzione in u 1990 di u screening anti-HCV di e donazioni di sangue, l'incidenza di sta infezione in i destinatari di trasfusione hè stata significativamente ridutta. Studi clinichi mostranu chì una quantità significativa di individui infettati da HCV sviluppanu anticorpi contr'à a proteina non strutturale NS5 di u virus. Per questu, i testi includenu antigeni da a regione NS5 di u genomu virale in più di NS3 (c200), NS4 (c200) è u Core (c22).
PRINCIPIU DI A PROCEDURA
A membrana di u dispusitivu di prova hè rivestita cù l'antigenu HCV nantu à a regione di prova è l'anticorpu IgG di capra anti-cunigliu nantu à a regione di cuntrollu. I cuscinetti di l'etichetta sò rivestiti in anticipu da l'antigenu HCV marcatu cù fluorescenza è l'IgG di cunigliu. Quandu si testa un campione pusitivu, l'anticorpu HCV in u campione si combina cù l'antigenu HCV marcatu cù fluorescenza, è forma una mistura immune. Sottu l'azione di l'immunocromatografia, u flussu di u cumplessu in a direzzione di a carta assorbente, quandu u cumplessu passa a regione di prova, si combina cù l'antigenu di rivestimentu di l'antigenu HCV, forma un novu cumplessu. U livellu di l'anticorpi HCV hè pusitivamente correlatu cù u signale di fluorescenza, è a cuncentrazione di l'anticorpi HCV in u campione pò esse rilevata da u test immunologicu di fluorescenza.
REAGENTI È MATERIALI FORNITI
Cumponenti di u pacchettu 25T::
Carta di prova imballata individualmente in foglia d'aluminiu cù un disseccante
Diluenti di campioni
Insertu di pacchettu
MATERIALI RICHIESTI MA NON FORNITI
Cuntenitore di raccolta di campioni, timer
RACCOLTA È CONSERVAZIONE DI CAMPIONI
1. I campioni testati ponu esse serum, plasma anticoagulante cù eparina o plasma anticoagulante cù EDTA.
2. Sicondu e tecniche standard, raccoglie u campione. U campione di serumu o di plasma pò esse cunservatu in frigorifero à 2-8 ℃ per 7 ghjorni è a crioconservazione sottu à -15 ° C per 6 mesi.
3. Tutti i campioni evitanu i cicli di congelazione-scongelazione.
PROCEDURA DI TEST
Leghjite u manuale d'usu di u strumentu è l'insertu di a cunfezione prima di fà a prova.
Stu risultatu di a prova hè solu per riferimentu clinicu, ùn deve micca serve cum'è l'unica basa per a diagnosi è u trattamentu clinicu, a gestione clinica di i pazienti deve esse cunsiderata cumpletamente inseme cù i so sintomi, a storia medica, altri esami di laburatoriu, a risposta à u trattamentu, l'epidemiologia è altre informazioni.
Stu reagente hè adupratu solu per i testi di serumu è plasma. Pò esse chì ùn ottenga micca risultati precisi quandu hè adupratu per altri campioni cum'è a saliva è l'urina, ecc.
CARATTERISTICHE DI PRESTAZIONE
| Linearità | 0,005-5 | deviazione relativa: da-15% à +15%. |
| Coefficiente di currelazione lineare: (r) ≥ 0,9900 | ||
| Precisione | U tassu di ricuperazione deve esse trà 85% è 115%. | |
| Ripetibilità | CV≤15% | |
REFERENZE
1. Epatite post-trasfusione. In: Moore SB, ed. Malatie virali trasmesse da trasfusione. Alington, VA. Am. Assoc. Banche di sangue, pp. 53-38.
2.Hansen JH, et al. Interferenza HAMA cù saggi immunologichi basati nantu à l'anticorpi monoclonali murini [J]. J of Clin Immunoassay, 1993, 16: 294-299.
3.Levinson SS. A Natura di l'Anticorpi Eterofili è u Rolu in l'Interferenza di l'Immunoassay [J]. J di Clin Immunoassay, 1992, 15: 108-114.
4. Alter HJ., Purcell RH, Holland PV, et al. (1978) Agente trasmissibile in l'epatite non-A, non-B. Lancet I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus di l'epatite C: u principale agente causativu di l'epatite virale non-A, non-B. Br Med Bull 46: 423-441.
6.Engvall E, Perlmann P. (1971) Saggio immunosorbente ligatu à l'enzimi (ELISA): analisi qualitativa di IgG. Immunochemistry 8:871-874.
VALORI ATTESI
HCV-Ab<0.02
Hè cunsigliatu chì ogni laburatoriu stabilisca u so propiu intervallu nurmale chì rapprisenta a so pupulazione di pazienti.
RISULTATI DI I TEST È INTERPRETAZIONE
- I dati sopra sò u risultatu di u test di reagenti HCV-Ab, è si suggerisce chì ogni laburatoriu stabilisca una gamma di valori di rilevazione HCV-Ab adatti per a pupulazione in questa regione. I risultati sopra sò solu per riferimentu.
- I risultati di stu metudu sò applicabili solu à i intervalli di riferimentu stabiliti in questu metudu, è ùn ci hè micca paragunabilità diretta cù altri metudi.
- Altri fattori ponu ancu causà errori in i risultati di rilevazione, cumpresi ragioni tecniche, errori operativi è altri fattori di campionamentu.
CONSERVAZIONE È STABILITÀ
- U kit hà una durata di conservazione di 18 mesi da a data di fabricazione. Cunservate i kit micca usati à 2-30 °C. ÙN CONGELATE MICCA. Ùn aduprate micca dopu a data di scadenza.
- Ùn aprite micca a busta sigillata finu à chì ùn site micca prontu à fà una prova, è si suggerisce di aduprà a prova à usu unicu in l'ambiente necessariu (temperatura 2-35 ℃, umidità 40-90%) in 60 minuti u più prestu pussibule.
- U diluente di campione hè adupratu subitu dopu l'apertura.
AVVERTENZE È PRECAUZIONI
U kit deve esse sigillatu è prutettu contr'à l'umidità.
Tutti i campioni pusitivi devenu esse validati da altre metodologie.
.Tutti i campioni devenu esse trattati cum'è inquinanti potenziali.
.ÙN aduprate micca reagente scadutu.
.ÙN scambiate micca i reagenti trà kit cù numeri di lottu diversi.
.ÙN riutilizate micca e carte di test è qualsiasi accessori dispunibili.
.Un funziunamentu sbagliatu, un campione eccessivu o pocu pò purtà à deviazioni di risultati.
LIMITAZIONE
.Cum'è cù qualsiasi analisi chì impiega anticorpi di topo, esiste a pussibilità d'interferenza da anticorpi umani anti-topo (HAMA) in u campione. I campioni di pazienti chì anu ricevutu preparazioni d'anticorpi monoclonali per diagnosi o terapia ponu cuntene HAMA. Tali campioni ponu causà risultati falsi pusitivi o falsi negativi.
Chjave di i simbuli utilizati:
 | Dispositivu Medicu Diagnosticu In Vitro |
 | Fabbricante |
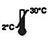 | Cunservà à 2-30 ℃ |
 | Data di perenzione |
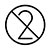 | Ùn riutilizà micca |
 | ATTENZIONE |
 | Cunsultate l'istruzzioni per l'usu |